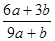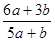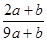题目内容
在100m L含等物质的量的HBr和H2SO3的溶液里通入0.025molCl2,有一半Br-变为Br2(已知Br2能氧化H2SO3 )。则原溶液中HBr和H2SO3的浓度都等于( )
| A.0.25mol·L-1 | B.0.002mol·L-1 | C.0.02mol·L-1 | D.0.2mol·L-1 |
D
试题分析:因为Br2能氧化H2SO3,所以H2SO3还原性较强。Cl2应先氧化H2SO3再氧化HBr。设等物质的量的HBr和H2SO3的物质的量为。
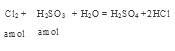 ,充分反应后余下的氯气再和HBr反应。
,充分反应后余下的氯气再和HBr反应。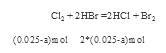 因为有一半Br-变为Br2,所以2*(0.025-a)mol=a/2 。所以可以求出a=0.002mol。可以求解:
因为有一半Br-变为Br2,所以2*(0.025-a)mol=a/2 。所以可以求出a=0.002mol。可以求解: 32->I->Fe2+>Br->Cl-这些离子的还原性的大小顺序。
32->I->Fe2+>Br->Cl-这些离子的还原性的大小顺序。
练习册系列答案
相关题目