题目内容
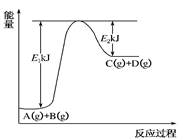
已知2H2(g)+O2(g)→2H2O(g)+483.6kJ。下列说法或表达正确的是
| A.在相同的条件下,2mol 氢气与 1 mol 氧气的总能量小于2mol 水蒸气的总能量 |
| B.H2(g)+1/2 O2(g)→H2O(1)+Q1;Q1>241.8kJ |
| C.H2(g)+ 1/2O2(g)→H2O(1)+Q2;Q2<241.8kJ |
| D.任何条件下,2L水蒸气分解成2L氢气与1L氧气需吸收483.6kJ热量 |
B
该反应为放热反应,故2mol 氢气与 1 mol 氧气的总能量大于2mol 水蒸气的总能量,A错。等物质的量的液态水比气态水能量低,所以生成液态水放热更多,故B正确,C错误。热化学方程式中的计量数只表示物质的量,故D错。所以选B

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
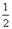 O2(g) △H1 =" +242" kJ·mol-1
O2(g) △H1 =" +242" kJ·mol-1 O2(g)="MgO(s) " △H3 = -602kJ·mol-1
O2(g)="MgO(s) " △H3 = -602kJ·mol-1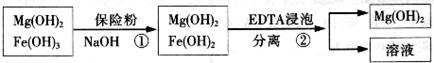
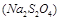 的作用: 。
的作用: 。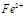 反应生成易溶于水的物质,不与
反应生成易溶于水的物质,不与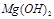 反应。虽然
反应。虽然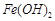 难溶于水,但步骤②中随着EDTA的加入,最终能够将
难溶于水,但步骤②中随着EDTA的加入,最终能够将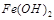 除去并获得纯度高的
除去并获得纯度高的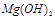 。请从沉淀溶解平衡的角度加以解释 ;
。请从沉淀溶解平衡的角度加以解释 ;
 化学键时ΔH<0[如2H(g)=H2(g) ΔH =" -" 436 kJ·mol-1]。
化学键时ΔH<0[如2H(g)=H2(g) ΔH =" -" 436 kJ·mol-1]。  共5mol,完全燃烧生成CO2和气态水时,则放出热量(
共5mol,完全燃烧生成CO2和气态水时,则放出热量( Q)的取值范围是 ;若生成CO2和H2O的物质的量相等,则放出的热量是 。
Q)的取值范围是 ;若生成CO2和H2O的物质的量相等,则放出的热量是 。