题目内容
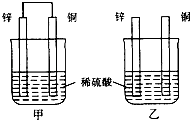
【题目】某化学兴趣设计实验制取乙酸乙酯.现用右图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2ml98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题: 
(1)写出圆底烧瓶内发生反应的化学方程式为: .
(2)反应中加入浓硫酸的作用是 .
(3)球形干燥管C的作用是 .
(4)反应结束后D中的现象是:
(5)分离出D中的乙酸乙酯时需要的玻璃仪器是 .
【答案】
(1)CH3COOH+CH3CH2OH ![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
(2)催化剂、吸水剂
(3)防止倒吸;充分冷凝乙酸乙酯蒸气
(4)有细小的气泡冒出,溶液分层,无色油状液体在上层
(5)分液漏斗
【解析】解:(1)实验中用乙醇与乙酸作用,酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应,所以乙酸脱羟基,乙醇脱氢离子,方程式为CH3COOH+CH3CH2OH ![]() CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
所以答案是:CH3COOH+CH3CH2OH ![]() CH3COOC2H5+H2O;(2)乙酸与乙醇在浓硫酸作催化剂加热条件下生成乙酸乙酯,由于反应为可逆反应,同时浓硫酸吸水有利于平衡向生成乙酸乙酯的方向移动,所以答案是:催化剂;吸水剂;(3)球形干燥管容积较大,可起到防止倒吸的作用,使乙酸乙酯充分与空气进行热交换,起到冷凝的作用,所以答案是:防止倒吸;充分冷凝乙酸乙酯蒸气;(4)烧杯中加入饱和Na2CO3溶液,因乙酸的酸性比碳酸强,所以乙酸能和碳酸钠反应生成二氧化碳气体,乙酸乙酯难溶于水,且密度比水小,在上层,实验观察到有细小的气泡冒出,溶液分层,无色油状液体在上层现象,所以答案是:有细小的气泡冒出,溶液分层,无色油状液体在上层;(5)乙酸乙酯中混有乙醇和乙酸,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,分离油层和水层采用分液的方法即可,所以用到的玻璃仪器为分液漏斗,所以答案是:分液漏斗;
CH3COOC2H5+H2O;(2)乙酸与乙醇在浓硫酸作催化剂加热条件下生成乙酸乙酯,由于反应为可逆反应,同时浓硫酸吸水有利于平衡向生成乙酸乙酯的方向移动,所以答案是:催化剂;吸水剂;(3)球形干燥管容积较大,可起到防止倒吸的作用,使乙酸乙酯充分与空气进行热交换,起到冷凝的作用,所以答案是:防止倒吸;充分冷凝乙酸乙酯蒸气;(4)烧杯中加入饱和Na2CO3溶液,因乙酸的酸性比碳酸强,所以乙酸能和碳酸钠反应生成二氧化碳气体,乙酸乙酯难溶于水,且密度比水小,在上层,实验观察到有细小的气泡冒出,溶液分层,无色油状液体在上层现象,所以答案是:有细小的气泡冒出,溶液分层,无色油状液体在上层;(5)乙酸乙酯中混有乙醇和乙酸,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,分离油层和水层采用分液的方法即可,所以用到的玻璃仪器为分液漏斗,所以答案是:分液漏斗;

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】海水中含有丰富的镁资源.某同学设计了从模拟海水中制备MgO的实验方案: 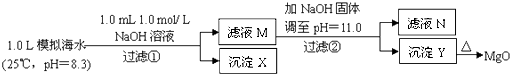
模拟海水中的 | Na+ | Mg2+ | Ca2+ | Cl﹣ | HCO3﹣ |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10﹣5 mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变.已知:Ksp(CaCO3)=4.96×10﹣9;Ksp(MgCO3)=6.82×10﹣6;Ksp[Ca(OH)2]=4.68×10﹣6;Ksp[Mg(OH)2]=5.61×10﹣12 . 下列说法正确的是( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+ , 不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2gNaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物