题目内容
【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。
(1)己知: N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
2C(S)+O2(g)=2CO(g) △H=-221kJ·mol-1
若某反应的平衡常数表达式c(N2)·c2(CO2)/ c(NO)·c2(CO)为: 请写出此反应的热化学方程式______________。
(2)利用H2和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)
CH2=CH2(g)+4H2O(g)
己知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法正确的是_____(填序号)。
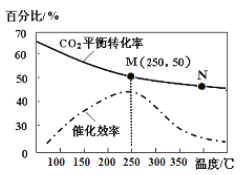
①不同条件下反应,N点的速率最大
②N点时平衡常数比M点时平衡常数小
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(2)在密闭容器中充入5molCO和4molNO,发生上述(1)中某反应,如图为平衡时NO的体积分数与温度,压强的关系。
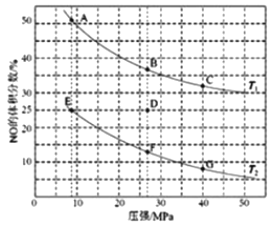
回答下列问题:
①温度:T1_______T2(填“<“ 或“>”)。
②某温度下,若反应进行到10 分钟达到平衡状态D点时,容器的体积为2L,则此时的平衡常数K=___(结果精确到两位小数);用CO的浓度变化表示的平均反应速率V(CO)=_______。
③若在D点对反应容器降温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中的______点。
【答案】 2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H =-746.5kJ·mol-1 ② > 0.22 mol·L-1 0.1mol mol·L-1·min-1 E
N2(g)+2CO2(g) △H =-746.5kJ·mol-1 ② > 0.22 mol·L-1 0.1mol mol·L-1·min-1 E
【解析】(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,则此反应的化学方程式为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ,已知①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1 ②C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1 ③2C(S)+O2(g)=2CO(g) △H=-221kJ·mol-1 ,由盖斯定律,△H=—①—③—②×2==—180.55kJ·mol-1—(-221kJ·mol-1)—-393.5kJ·mol-1×2= △H =-746.5kJ·mol-1,故反应的热化学方程式为:2NO(g)+2CO(g)
N2(g)+2CO2(g) ,已知①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1 ②C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1 ③2C(S)+O2(g)=2CO(g) △H=-221kJ·mol-1 ,由盖斯定律,△H=—①—③—②×2==—180.55kJ·mol-1—(-221kJ·mol-1)—-393.5kJ·mol-1×2= △H =-746.5kJ·mol-1,故反应的热化学方程式为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H =-746.5kJ·mol-1;
N2(g)+2CO2(g) △H =-746.5kJ·mol-1;
(2)①温度升高,速率加快,但催化效率降低,说明在温度过高升高后,催化剂失去了催化活性,速率反而降低,故①不正确;
②由CO2的转化率随温度变化曲线可知,温度升高,CO2的转化率下降,平衡逆向移动,则N点时平衡常数比M点时平衡常数小,②正确;
③图中曲线是CO2的平衡转化率,温度升高,CO2的转化率下降,平衡逆向移动,乙烯的产率减小,故③不正确;
④温度较低,催化剂可能失去催化活性,速率太低。所以,在实际反应时,需要综合考虑影响因素,选择适宜温度、压强,增大氢气浓度等来提高CO2的转化率,故D不正确。
(3)①图为平衡时NO的体积分数与温度,压强的关系,此反应是放热反应,在相压强下,T1时的NO的体积分数大于T2时的NO的体积分数,平衡逆向移动,是由温度升高引起的,所以,T1>T2;
②某温度下,反应达到平衡状态D点时,NO的体积分数是25%,设CO的变化浓度是x, 2CO(g)+2NO(g)N2(g)+2CO2(g)
初始浓度:2.5 2 0 0
变化浓度:x x 0.5x x
平衡浓度:2.5-x 2-x 0.5x x
NO的体积分数是25%,即(2-x)/[ 2.5-x+2- x+0.5x+x] ×100%=25%,解得x=1,此时K=12×0.5/1.52×1=0.22;V(CO)= =△c/△t=1mol/L÷10min= 0.1 mol·L-1·min-1;
③若在D点对反应容器降低温度,D向F点移动(T2线温度低),同时扩大体积使体系压强减小,则平衡会逆向移动,NO的体积分数增加,重新达到的平衡状态可能是图中E点。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知X、Y、Z三种短周期元素在周期表中的位置如图所示,设X的原子序数为a。则下列说法正确的是
Y | ||
X | ||
Z |
A.Y是非金属性最强的元素
B.Z是金属元素
C.Y的原子序数为a-7
D.X的气态氢化物化学式为H2X
【题目】用提供的试剂(溴水、浓硝酸 、碘水、新制氢氧化铜浊液)分别鉴别下列有机物,将所用试剂及产生的现象的序号填在横线上。
序号 | 待鉴别的物质 | 试剂 | 现象 |
① | 乙烯 | _____ | ____________ |
② | 葡萄糖 | _____ | ___________ |
③ | 淀粉 | _____ | ___________ |

