题目内容
南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于________硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂添加顺序为________,原因是___________________________________。
(3)目前常用阴、阳离子交换树脂来进行水的软化,水中的Ca2+、Mg2+与交换树脂的____________起离子交换作用。当阴离子交换树脂失效后可放入__________溶液中再生。
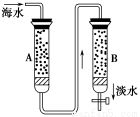
(4)岛上还可以用海水淡化来获得淡水。下面是将海水通过电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:
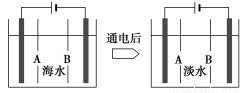
①阳离子交换膜是指__________(填“A”或“B”)。
②写出通电后阳极区的电极反应式:_________________________________;
阴极区的现象是:_________________________________________________。
(1)永久 (2)先加石灰后加纯碱 过量的钙离子可通过纯碱使之沉淀下来
(3)H+ 强碱
(4)①B ②2Cl--2e-=Cl2↑ 电极上产生无色气体,溶液中出现少量白色沉淀
【解析】(1)含CaCl2、MgCl2、CaSO2的硬于水属于永久硬水。
(2)先加石灰除去Mg2+,后加纯碱除去过量的Ca2+。
(3)Ca2+、Mg2+与H+交换,阴离子与OH-交换。
(4)阳离子通过阳离子交换膜,在阴极附近,故选B,阳极区是Cl-反应。阴极区2H2O+2e-=H2↑+2OH-,OH-与Mg2+形成Mg(OH)2沉淀。