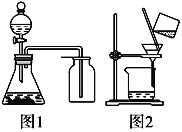
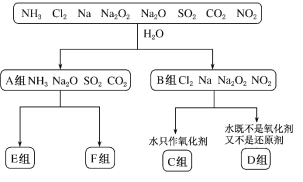
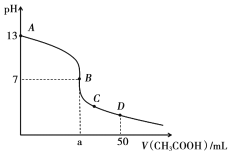
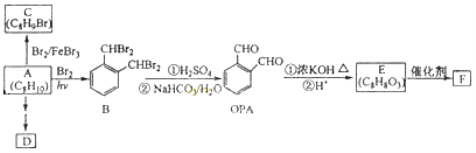
题目内容
【题目】在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
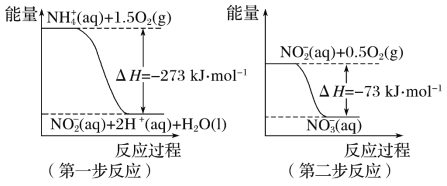
(1)第一步反应是________(填“放热”或“吸热”)反应。
(2)1mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是____________________________。
【答案】放热 NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1
【解析】
(1)反应物总能量高于生成物总能量,为放热反应;
(2)结合图象根据盖斯定律来计算反应的焓变。
(1)由图象可知,反应物总能量高于生成物总能量,ΔH=273kJmol-1<0,焓变小于0,则反应为放热反应,故答案为:放热;
(2)第一步的热化学方程式为NH4+(aq)+![]() O2(g)=NO2(aq)+2H+(aq)+H2O(l) ΔH=273kJmol-1,第二步的热化学方程式为:NO2(aq)+
O2(g)=NO2(aq)+2H+(aq)+H2O(l) ΔH=273kJmol-1,第二步的热化学方程式为:NO2(aq)+![]() O2(g)=NO3(aq) ΔH=73kJmol-1,根据盖斯定律则NH4+(aq)+2O2(g)=NO3(aq)+2H+(aq)+H2O(l) ΔH=346kJmol-1,故答案为:NH4+(aq)+2O2(g)=NO3(aq)+2H+(aq)+H2O(l) ΔH=346kJmol-1。
O2(g)=NO3(aq) ΔH=73kJmol-1,根据盖斯定律则NH4+(aq)+2O2(g)=NO3(aq)+2H+(aq)+H2O(l) ΔH=346kJmol-1,故答案为:NH4+(aq)+2O2(g)=NO3(aq)+2H+(aq)+H2O(l) ΔH=346kJmol-1。

 阅读快车系列答案
阅读快车系列答案【题目】甲醇作为可再生能源,越来越受到人们的关注。已知甲醇制备的有关化学反应的平衡常数及焓变数据如下
化学反应 | 500℃平衡常数 | 焓变 |
①CO(g)+2H2(g) | K1=2.5 | ΔH1=-116 kJ·mol-1 |
②CO2(g)+H2(g) | K2=1.0 | ΔH2=+41 kJ·mol-1 |
③CO2(g)+3H2(g) | K3=? | ΔH3=? |
(1)反应③的K3=__________________,ΔH3=__________________。
(2)500℃时,将2mol CO2和2mol H2充入2L的恒容密闭容器中发生反应②,5min后达到平衡后,则0~5min内,用H2表示的反应速率v(H2)=________。
(3)500℃时,测得反应③在某时刻CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.1、0.8、0.3、0.15,则此时v正_________v逆(填“>”“<”或“=”)。
(4)若一定量的CO2和H2在绝热恒容的条件下发生上述反应②,下列可以作为判断该反应达到平衡的标志有_________________________。
a.混合气体的平均相对分子质量不再改变
b.混合气体中CO2、H2、H2O、CO(g)的含量相等
c. v(CO2)生成=v(CO)消耗
d.容器内温度不再变化
【题目】25 ℃时有关物质的颜色和溶度积(Ksp)如下表:
物质 | AgCl | AgBr | AgI | Ag2S |
颜色 | 白 | 淡黄 | 黄 | 黑 |
Ksp | 1.8×10-10 | 7.7×10-13 | 1.5×10-16 | 1.8×10-50 |
下列叙述中不正确的是( )
A.向AgCl的白色悬浊液中加入0.1 mol/L KI溶液,有黄色沉淀产生
B.25 ℃时,利用表中的溶度积(Ksp),可以计算AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度
C.25 ℃,AgCl固体分别在等物质的量浓度NaCl、CaCl2溶液中溶解达到平衡,两溶液中,c(Ag+)和溶度积均相同
D.在5 mL 1.8×10-6 mol/L NaCl溶液中,加入1滴(20滴约为1 mL)1×10-3 mol/L AgNO3溶液,不能产生白色沉淀