题目内容
【题目】甲醇作为可再生能源,越来越受到人们的关注。已知甲醇制备的有关化学反应的平衡常数及焓变数据如下
化学反应 | 500℃平衡常数 | 焓变 |
①CO(g)+2H2(g) | K1=2.5 | ΔH1=-116 kJ·mol-1 |
②CO2(g)+H2(g) | K2=1.0 | ΔH2=+41 kJ·mol-1 |
③CO2(g)+3H2(g) | K3=? | ΔH3=? |
(1)反应③的K3=__________________,ΔH3=__________________。
(2)500℃时,将2mol CO2和2mol H2充入2L的恒容密闭容器中发生反应②,5min后达到平衡后,则0~5min内,用H2表示的反应速率v(H2)=________。
(3)500℃时,测得反应③在某时刻CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.1、0.8、0.3、0.15,则此时v正_________v逆(填“>”“<”或“=”)。
(4)若一定量的CO2和H2在绝热恒容的条件下发生上述反应②,下列可以作为判断该反应达到平衡的标志有_________________________。
a.混合气体的平均相对分子质量不再改变
b.混合气体中CO2、H2、H2O、CO(g)的含量相等
c. v(CO2)生成=v(CO)消耗
d.容器内温度不再变化
【答案】2.5 -75 kJ·mol-1 0.1mol/(L![]() min) > d
min) > d
【解析】
(1)反应①+②可得反应③,则平衡常数K3=K1×K2,焓变ΔH3=ΔH1+ΔH2;
(2)利用“三段式法”和化学平衡常数的表达式计算出H2浓度的变化量,用H2表示的反应速率v(H2)=![]() ;
;
(3)500℃时K3=K1×K2=2.5,再计算此时浓度商Qc,若Qc=K3,处于平衡状态,若Qc<K3,反应向正反应进行,若Qc>K3,反应向逆反应进行,进而判断v正、v逆相对大小;
(4)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析。
(1)反应①+②可得反应③,则平衡常数K3=K1×K2=2.5×1.0=2.5,焓变ΔH3=ΔH1+ΔH2=-116kJ·mol-1+(+41kJ·mol-1)=-75kJ·mol-1,故答案为:2.5;-75kJ·mol-1;
(2)500℃时,将2molCO和2molH2充入2L的恒容密闭容器中发生反应②, 5min后达到平衡,由反应三段式得:
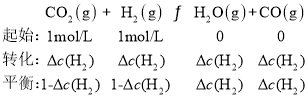
K2=![]() =1.0,解得
=1.0,解得![]() =0.5mol/L,v(H2)=
=0.5mol/L,v(H2)=![]() =
=![]() =0.1mol/(L
=0.1mol/(L![]() min),故答案为:0.1mol/(L
min),故答案为:0.1mol/(L![]() min);
min);
(3)500℃时K3=K1×K2=2.5,浓度商Qc=![]() =0.88<K3=2.5,反应向正反应进行,故v正>v逆,故答案为:>;
=0.88<K3=2.5,反应向正反应进行,故v正>v逆,故答案为:>;
(4) a.反应总质量是个定值,总物质的量是个定值,混合气体的平均相对分子质量一直不变,故a不符合题意;
b.混合气体中CO2、H2、H2O、CO的含量相等,不一定达到平衡状态,故b不符合题意;
c.v(CO2)生成、v(CO)消耗是逆反应的两种物质化学反应速率,不能证明v正=v逆,故c符合题意;
d.绝热容器内温度不再发生变化说明反应达到了平衡,故d符合题意;
故答案为:d。

 阅读快车系列答案
阅读快车系列答案