题目内容
【题目】3.2g某元素A的单质与氢气化合生成3.4g气态氢化物H2A,已知A的原子核中质子数和中子数相等,则:
(1)A的原子序数为?
(2)元素A位于元素周期表中什么位置?
(3)书写气态氢化物的电子式.
【答案】
(1)解:根据质量守恒定律,3.2g某元素A的单质与氢气化合生成3.4g气态氢化物H2A,参加反应的氢气的质量为3.4g﹣3.2g=0.2g,n(H2)= ![]() =0.1mol,元素A气态氢化合物的化学式H2A,反应为:H2+A=H2A,则n(H2)=n(H2A)=n(A)=0.1mol,M(A)=
=0.1mol,元素A气态氢化合物的化学式H2A,反应为:H2+A=H2A,则n(H2)=n(H2A)=n(A)=0.1mol,M(A)= ![]() =
= ![]() =32g/mol,摩尔质量与相对分子质量数值相等,A的原子核中质子数和中子数相等,所以A的原子序数为
=32g/mol,摩尔质量与相对分子质量数值相等,A的原子核中质子数和中子数相等,所以A的原子序数为 ![]() =16,
=16,
答:A的原子序数为16;
(2)解:原子序数为16为硫,原子结构示意图为 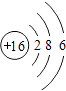 属于第三周期第ⅥA族,
属于第三周期第ⅥA族,
答:元素A位于元素周期表中第三周期第ⅥA族;硫化氢的电子式为 ![]() .
.
(3)解: H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H﹣S键,电子式为: ![]()
【解析】(1)根据质量守恒定律,3.2g某元素A的单质与氢气化合生成3.4g气态氢化物H2A,求出参加反应的氢气的质量,根据n(H2)=n(H2A)=n(A),求出n(A),根据M(A)= ![]() 求出A的摩尔质量,摩尔质量与相对分子质量数值相等,A的原子核中质子数和中子数相等,进而求出A的原子序数,确定该元素;(2)对于主族元素,周期数=电子层数,族序数=最外层电子数.据此判断该元素在周期表中位置;(3)H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H﹣S键.
求出A的摩尔质量,摩尔质量与相对分子质量数值相等,A的原子核中质子数和中子数相等,进而求出A的原子序数,确定该元素;(2)对于主族元素,周期数=电子层数,族序数=最外层电子数.据此判断该元素在周期表中位置;(3)H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H﹣S键.

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案【题目】有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)A原子的核外电子排布式为 .
(2)B元素在周期表中的位置为;离子半径:BA(填“大于”或“小于”).
(3)C原子的电子排布图是 , 其原子核外有个未成对电子,能量最高的电子为轨道上的电子,其轨道呈形.
(4)D原子的电子排布式为 , D﹣的结构示意图是 .

