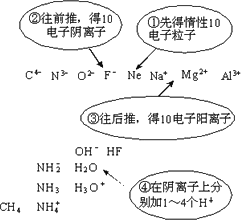
题目内容
A、B、C、D都是10电子粒子.
(1)A为中性粒子.如果A能刻蚀玻璃,则A是________(写化学式,下同);如果A溶液显碱性,则A是________.
(2)B为带电粒子.如果B为阳离子,且其水溶液使紫色石蕊变红色,则B是________;如果B为阴离子,且其水溶液使无色酚酞变红色,则B是________.
(3)C粒子中含有5个原子,带正电荷,遇碱放出NH3,C为________.
(4)D粒子遇阳离子B,先生成沉淀,后沉淀溶解,D是________.
答案:
解析:
解析:
|
(1)答案:HF NH3 解析:本题有两种解法. 方法1(有序思维法):先找出所有的10电子粒子:
再将所得10电子粒子与题意对应,可知答案. 方法2(现象判定法):(1)能刻蚀玻璃,应为HF;中性粒子溶于水显碱性,应为NH3. (2)答案:H3O+ OH- 解析:阳离子使石蕊变红色,应为H3O+;阴离子使酚酞变红色,应为OH-. (3)答案:NH 解析:5原子离子,遇碱放出NH3,应为NH (4)答案:Al3+ 解析:跟少量 OH-作用生成沉淀,跟过量OH-作用沉淀溶解,是Al3+. |

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
A、B、C、D都是短周期元素,原子半径:D>C>A>B.已知:A、B同周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的3倍.下列说法中正确的是( )
| A、A、C两元素可能处于第ⅢA族或第ⅥA族 | B、B、D两元素组成的两种离子化合物中阴、阳离子数之比为2:1或1:1 | C、B、C、D三种元素的简单离子的半径大小顺序为:C>D>B | D、B、C、D三种元素组成的化合物的化学式为DCB2 |
A、B、C、D都是短周期元素,原子半径:D>C>A>B.已知:A、B同周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的3倍,下列说法正确的是( )
| A、A的元素符号为Be | B、B和D两种元素形成的化合物中只能含有离子键 | C、C和D两元素的最高价氧化物的水化物相互反应生成盐和水 | D、D2B和D2B2阴、阳离子个数比分别为1:2和1:1 |