题目内容
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液。为点燃上述三个反应生成的H2,他们设计了如右图所示的装置图:
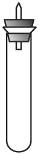
]请回答下列问题:
(1)写出Al和NaOH溶液反应的离子方程式_______________________________。
(2)在点燃H2之前必须先进行____________________________________________。
(3)实验小组在点燃用上述装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量又太少。于是他们准备增加钠的用量,可教师说太危险,你认为产生危险的原因是___________________________。
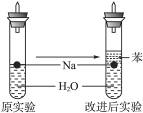
(4)实验小组查阅钠、苯(一种不溶于水的液态有机物)、水的密度分别为0.97 g·mL-1、0.88 g·mL-1、1.00 g·mL-1,并据此对实验进行了改进。在改进后的实验中H2的生成速率______________________。(填“减慢”或“加快”)
(5)2.3 g钠投入20 mL水中完全反应放出的气体在标准状况下的体积是_____________,所得溶液的物质的量浓度是______________________。(不计溶液体积的变化)
]请回答下列问题:
(1)写出Al和NaOH溶液反应的离子方程式_______________________________。
(2)在点燃H2之前必须先进行____________________________________________。
(3)实验小组在点燃用上述装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量又太少。于是他们准备增加钠的用量,可教师说太危险,你认为产生危险的原因是___________________________。
(4)实验小组查阅钠、苯(一种不溶于水的液态有机物)、水的密度分别为0.97 g·mL-1、0.88 g·mL-1、1.00 g·mL-1,并据此对实验进行了改进。在改进后的实验中H2的生成速率______________________。(填“减慢”或“加快”)

(5)2.3 g钠投入20 mL水中完全反应放出的气体在标准状况下的体积是_____________,所得溶液的物质的量浓度是______________________。(不计溶液体积的变化)
(1)2Al+2H2O+2NaOH====2NaAlO2+3H2↑(2)验纯
(3)较多的钠与水反应放出大量的热,使试管内H2与O2的混合气点燃而爆炸
(4)减慢(5)1.12 L 5 mol·L-1
(3)较多的钠与水反应放出大量的热,使试管内H2与O2的混合气点燃而爆炸
(4)减慢(5)1.12 L 5 mol·L-1
可燃性气体在点燃前必须验纯,避免爆炸。在试管中不要放入大块的Na,避免较多的钠与水反应放出大量的热,使试管内H2与O2的混合气点燃而爆炸;钠块表面会附着苯,所以改进后的实验中H2的生成速率减慢;2Na+2H2O====2NaOH+H2↑,0.1 mol Na反应放出氢气为1.12 L;所得溶液的物质的量浓度=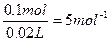 。
。
 。
。
练习册系列答案
相关题目
 。
。