题目内容
某天然碱的化学组成可能为aNa2CO3·bNaHCO3·cH2O (a、b、c为正整数),为确定其组成,化学兴趣小组的同学进行了如下实验:
(1)定性分析:
①取少量天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝。能否说明样品中含结晶水,试简述理由。_________________________________。
②请你设计一个简单的实验方案,确认样品中含有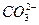 。
。
______________________________________________________________________________。
(2)定量分析:该小组同学设计了下图所示装置,测定天然碱的化学组成。
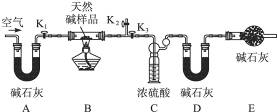
实验步骤:
①按上图(夹持仪器未画出)组装好实验装置后,首先进行的操作是____________________。
A处碱石灰的作用是_______________,E处碱石灰的作用是__________________________。
②称取天然碱样品7.3 g,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶的质量为87.6 g,装碱石灰的U形管D的质量为74.7 g。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热,待不再产生气体为止。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后称得装浓硫酸的洗气瓶质量为88.5 g;装碱石灰的U形管D的质量为75.8 g。该步骤中缓缓鼓入空气数分钟的目的是_____________。计算推导:该天然碱的化学式为_____________。
(1)定性分析:
①取少量天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝。能否说明样品中含结晶水,试简述理由。_________________________________。
②请你设计一个简单的实验方案,确认样品中含有
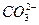 。
。______________________________________________________________________________。
(2)定量分析:该小组同学设计了下图所示装置,测定天然碱的化学组成。

实验步骤:
①按上图(夹持仪器未画出)组装好实验装置后,首先进行的操作是____________________。
A处碱石灰的作用是_______________,E处碱石灰的作用是__________________________。
②称取天然碱样品7.3 g,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶的质量为87.6 g,装碱石灰的U形管D的质量为74.7 g。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热,待不再产生气体为止。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后称得装浓硫酸的洗气瓶质量为88.5 g;装碱石灰的U形管D的质量为75.8 g。该步骤中缓缓鼓入空气数分钟的目的是_____________。计算推导:该天然碱的化学式为_____________。
(1)定性分析:
①不能,因为NaHCO3受热分解也能产生水蒸气
②取少量样品溶于水,滴加CaCl2(或BaCl2)溶液,有白色沉淀生成,说明有CO2-3
(2)定量分析:
①检查装置的气密性除去空气中的CO2和H2O(g)
防止空气中CO2和H2O(g)进入D装置导致测量不准确
⑤将装置中生成的CO2和H2O(g)全部排入C、D装置中被吸收 Na2CO3·2NaHCO3·H2O
①不能,因为NaHCO3受热分解也能产生水蒸气
②取少量样品溶于水,滴加CaCl2(或BaCl2)溶液,有白色沉淀生成,说明有CO2-3
(2)定量分析:
①检查装置的气密性除去空气中的CO2和H2O(g)
防止空气中CO2和H2O(g)进入D装置导致测量不准确
⑤将装置中生成的CO2和H2O(g)全部排入C、D装置中被吸收 Na2CO3·2NaHCO3·H2O
本题考查Na2CO3和NaHCO3有关性质、计算和离子的检验,综合性较强。(1)由于2NaHCO3 Na2CO3+CO2↑+H2O,所以不能说明样品中含结晶水。Ca2++
Na2CO3+CO2↑+H2O,所以不能说明样品中含结晶水。Ca2++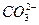 ====CaCO3↓是较熟悉的知识点,检验
====CaCO3↓是较熟悉的知识点,检验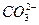 的存在,注意不能用澄清石灰水、盐酸来检验,原因是有
的存在,注意不能用澄清石灰水、盐酸来检验,原因是有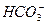 的干扰。(2)在定量分析时,就是利用2NaHCO3
的干扰。(2)在定量分析时,就是利用2NaHCO3 Na2CO3+CO2↑+H2O 这个原理。由题意可知:装碱石灰的U形管D的增重物质是CO2质量为75.8 g-74.7="1.1" g,n(CO2)=0.025 mol。
Na2CO3+CO2↑+H2O 这个原理。由题意可知:装碱石灰的U形管D的增重物质是CO2质量为75.8 g-74.7="1.1" g,n(CO2)=0.025 mol。
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
2 1 1 1
0.05 mol0.025 mol0.025 mol0.025 mol
m(NaHCO3)="0.05" mol×84 g·mol-1="4.2" g
所以晶体中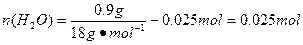 ,
,
m(H2O)="0.025" mol×18 g·mol-1="0.45" g
m(Na2CO3)=7.3 g-4.2 g-0.45 g=2.65 g,
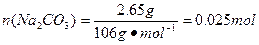 。由此可知晶体中
。由此可知晶体中
n(Na2CO3)∶n(NaHCO3)∶n(H2O)=0.025 mol∶0.05 mol∶0.025 mol=1∶2∶1。
所以晶体化学式为Na2CO3·2NaHCO3·H2O。
 Na2CO3+CO2↑+H2O,所以不能说明样品中含结晶水。Ca2++
Na2CO3+CO2↑+H2O,所以不能说明样品中含结晶水。Ca2++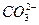 ====CaCO3↓是较熟悉的知识点,检验
====CaCO3↓是较熟悉的知识点,检验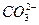 的存在,注意不能用澄清石灰水、盐酸来检验,原因是有
的存在,注意不能用澄清石灰水、盐酸来检验,原因是有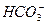 的干扰。(2)在定量分析时,就是利用2NaHCO3
的干扰。(2)在定量分析时,就是利用2NaHCO3 Na2CO3+CO2↑+H2O 这个原理。由题意可知:装碱石灰的U形管D的增重物质是CO2质量为75.8 g-74.7="1.1" g,n(CO2)=0.025 mol。
Na2CO3+CO2↑+H2O 这个原理。由题意可知:装碱石灰的U形管D的增重物质是CO2质量为75.8 g-74.7="1.1" g,n(CO2)=0.025 mol。2NaHCO3
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O2 1 1 1
0.05 mol0.025 mol0.025 mol0.025 mol
m(NaHCO3)="0.05" mol×84 g·mol-1="4.2" g
所以晶体中
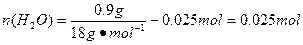 ,
,m(H2O)="0.025" mol×18 g·mol-1="0.45" g
m(Na2CO3)=7.3 g-4.2 g-0.45 g=2.65 g,
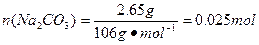 。由此可知晶体中
。由此可知晶体中n(Na2CO3)∶n(NaHCO3)∶n(H2O)=0.025 mol∶0.05 mol∶0.025 mol=1∶2∶1。
所以晶体化学式为Na2CO3·2NaHCO3·H2O。

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案
相关题目