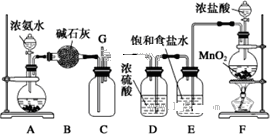
题目内容
某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置.
请回答下列问题:
(1)装置F中发生反应的离子方程式为
(2)B装置的作用
(3)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出反应的化学方程式:
计算生成2.8gN2转移电子数为
(4)G中的尾气可用
请回答下列问题:

(1)装置F中发生反应的离子方程式为
MnO2+4H++2C1-
Mn2++C12↑+2H2O.
| ||
MnO2+4H++2C1-
Mn2++C12↑+2H2O.
.
| ||
(2)B装置的作用
干燥氨气
干燥氨气
.(3)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出反应的化学方程式:
3Cl2+8NH3=N2+6NH4Cl
3Cl2+8NH3=N2+6NH4Cl
(写总式);计算生成2.8gN2转移电子数为
0.6NA
0.6NA
(NA代表阿伏伽德罗常数).(4)G中的尾气可用
NaOH
NaOH
溶液吸收.分析:(1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,注意稀盐酸和二氧化锰不反应.
(2)根据碱石灰的性质分析其作用.
(3)氨气和氯化氢气体反应生成白烟氯化铵,根据元素守恒配制另一种物质;根据氮气和转移电子之间的关系式计算.
(4)根据气体的性质选取尾气处理试剂.
(2)根据碱石灰的性质分析其作用.
(3)氨气和氯化氢气体反应生成白烟氯化铵,根据元素守恒配制另一种物质;根据氮气和转移电子之间的关系式计算.
(4)根据气体的性质选取尾气处理试剂.
解答:解:(1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,MnO2+4H++2C1-
Mn2++C12↑+2H2O.
故答案为:MnO2+4H++2C1-
Mn2++C12↑+2H2O.
(2)从A装置中导出的氨气含有水蒸气,碱石灰是碱性物质能吸收水分而不吸收氨气,所以碱石灰的作用是干燥氨气.
故答案为:除去氨气中的水蒸气(或干燥氨气).
(3)氨气和氯化氢气体反应生成白烟氯化铵,另一生成物是空气的主要成分之一,根据元素守恒知,另一种物质是氮气,所以反应方程式为:3Cl2+8NH3=N2+6NH4Cl;
3Cl2+8NH3=N2+6NH4Cl 转移电子
28g 6NA
2.8g 0.6NA
所以生成2.8gN2转移电子数为0.6NA.
故答案为:3Cl2+8NH3=N2+6NH4Cl;0.6NA.
(4)未反应的氯气能和水反应生成盐酸和次氯酸,酸能和碱发生中和反应,所以尾气中的氯气可用氢氧化钠溶液吸收.
故答案为:NaOH.
| ||
故答案为:MnO2+4H++2C1-
| ||
(2)从A装置中导出的氨气含有水蒸气,碱石灰是碱性物质能吸收水分而不吸收氨气,所以碱石灰的作用是干燥氨气.
故答案为:除去氨气中的水蒸气(或干燥氨气).
(3)氨气和氯化氢气体反应生成白烟氯化铵,另一生成物是空气的主要成分之一,根据元素守恒知,另一种物质是氮气,所以反应方程式为:3Cl2+8NH3=N2+6NH4Cl;
3Cl2+8NH3=N2+6NH4Cl 转移电子
28g 6NA
2.8g 0.6NA
所以生成2.8gN2转移电子数为0.6NA.
故答案为:3Cl2+8NH3=N2+6NH4Cl;0.6NA.
(4)未反应的氯气能和水反应生成盐酸和次氯酸,酸能和碱发生中和反应,所以尾气中的氯气可用氢氧化钠溶液吸收.
故答案为:NaOH.
点评:本题考查了氨气和氯气的制取及性质,难度不大,注意浓盐酸能和二氧化锰反应而稀盐酸和二氧化锰不反应.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目