题目内容
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为( )。
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
C
解析

练习册系列答案
相关题目
下列说法正确的是( )
| A.N2、CS2、H2O、CH4都是非极性分子 |
| B.SiO2、CsCl、HCl、HF四种晶体的熔点逐渐降低 |
| C.CO2、PCl3、CCl4、CH4四种分子中,各原子都满足最外层8电子结构 |
| D.由原子序数为1和8、1和6的元素,可分别形成原子数之比为1:1的化合物 |
如果取一块冰放在容器里,不断地升高温度,可以实现“冰→水→水蒸气→氢气和氧气”的变化,在各步变化时破坏的粒子间的相互作用力依次是( )。
| A.氢键、极性键、非极性键 |
| B.氢键、氢键、极性键 |
| C.氢键、氢键、非极性键 |
| D.氢键、非极性键、极性键 |
下列分子中的碳原子采取sp2杂化的是( )。
| A.C2H2 | B.C2H4 | C.C3H8 | D.CO2 |
H2S分子中两个共价键的夹角接近90°,其原因是( )。
| A.共价键的饱和性 |
| B.S原子电子排布 |
| C.共价键的方向性 |
| D.S原子中p轨道的形状和空间伸展方向 |
氢化铵(NH4H)与氯化铵的结构相似,又知它与水反应有气体生成。下列关于氢化铵叙述不正确的是( )。
| A.是离子化合物,含有离子键和共价键 |
B.电子式是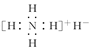 |
| C.与水反应时,是还原剂 |
| D.固体投入少量的水中,有两种气体产生 |
CH4、NH3、H2O、HF分子中,共价键的极性由强到弱的顺序是( )。
| A.CH4、NH3、H2O、HF |
| B.HF、H2O、NH3、CH4 |
| C.H2O、HF、CH4、NH3 |
| D.HF、H2O、CH4、NH3 |
下列表示物质结构的化学用语正确的是( )
| A.8个中子的碳原子的核素符号:12C |
B.HF的电子式: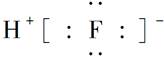 |
C.Cl-离子的结构示意图: |
| D.CO2的结构式:O=C=O |
下列说法中正确的是( )
| A.非金属元素原子组成的化合物不可能是离子化合物 |
| B.ⅠA族元素的金属性不一定比ⅡA族元素的金属性强 |
| C.同一主族元素组成的化合物一定是共价化合物 |
| D.通过化学变化可以实现18O与16O间的相互转化 |