题目内容
某温度下,在一个体积为2L的固定不变的密闭容器中充入0.3mol SO2和0.2mol O2,发生2SO2+O2?2SO3反应.5分钟后反应达到化学平衡状态,测得容器中气体压强变为原的90%.则
(1)ν(SO3)= mol?L-1?min-1;
(2)该反应中SO2的平衡转化率是 %.
(1)ν(SO3)=
(2)该反应中SO2的平衡转化率是
考点:化学平衡的计算
专题:化学平衡专题
分析:设平衡时转化的氧气的物质的量为x,根据同温同体积时气体的压强之比等于物质的量之比,利用三段式法计算反应的氧气的物质的量,进而计算出反应的三氧化硫的物质的量,则可求出反应速率;根据反应方程式计算出反应的二氧化硫的物质的量,进而求出反应中SO2的平衡转化率.
解答:
解:设平衡时转化的氧气的物质的量为x,利用三段式法计算.
2SO2+O2 2SO3
2SO3
初始 0.3mol 0.2mol 0
变化 2x x 2x
平衡 0.3mol-2x 0.2mol-x 2x
同温同体积下
=
=90%,解得x=0.05mol,
(1)平衡时n(SO3)=2×0.05mol=0.1mol,则ν(SO3)=
=0.01mol/(L?min),故答案为:0.01;
(2)平衡时反应的物质的量为2×0.05mol=0.1mol,则SO2的转化率为
××100%=33.3%,故答案为:33.3;
2SO2+O2
初始 0.3mol 0.2mol 0
变化 2x x 2x
平衡 0.3mol-2x 0.2mol-x 2x
同温同体积下
| P1 |
| P2 |
| 0.3mol-2x+0.2mol-x+2x |
| 0.3mol+0.2mol |
(1)平衡时n(SO3)=2×0.05mol=0.1mol,则ν(SO3)=
| 2×0.05mol |
| 2L×5min |
(2)平衡时反应的物质的量为2×0.05mol=0.1mol,则SO2的转化率为
| 2×0.05mol |
| 0.03mol |
点评:本题考查化学平衡的有关计算,题目难度不大,本题注意根据阿伏伽德罗定律,利用三段式法计算.

练习册系列答案
相关题目
阿司匹林是日常生活中应用广泛的医药之一.它可由下列方法合成: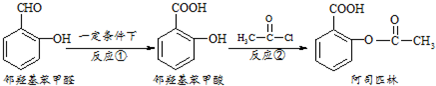
下列说法正确的是( )

下列说法正确的是( )
| A、邻羟基苯甲醇分子中所有的原子不可能在同一平面 |
| B、用酸性KMnO4溶液直接氧化邻羟基苯甲醛可实现反应① |
| C、反应②中加入适量的NaHCO3可提高阿司匹林的产率 |
| D、与邻羟基苯甲酸互为同分异构体,苯环上一氯代物仅有2种且能发生银镜反应的酚类化合物共有2种 |
下列气体能使酸性高锰酸钾溶液褪色但又难溶于水,又可用分液漏斗及烧瓶(或广口瓶)不加热装置制取的是( )
| A、H2 |
| B、SO2 |
| C、CH2=CH2 |
| D、CH≡CH |
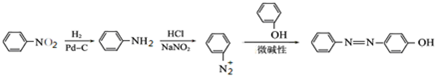
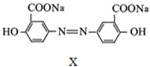 .以有机物A为原料合成X的路线如下:
.以有机物A为原料合成X的路线如下: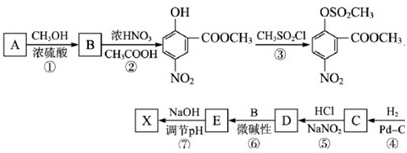
 在一个2L的密闭容器中,发生反应:
在一个2L的密闭容器中,发生反应: