��Ŀ����
�״�ȼ�ϵ�ص�����ܶࡣ
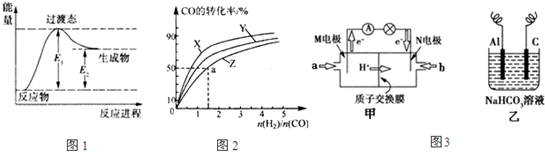
��1�����dz��õ�һ�ּ״�ȼ�ϵ�أ����Լ״��������ķ�ӦΪԭ����Ƶģ���������Һ��KOH��Һ��д���õ�ظ����ĵ缫��Ӧʽ_______________��
��2����ͼΪ���ñʼDZ��������ü״����ӽ���Ĥȼ�ϵ�صĽṹʾ��ͼ����װ����________���a����b����Ϊ��ص������� ��֪�κη�Ӧ������һ���Ŀ����ԡ��ü״����ӽ���Ĥȼ�ϵ����ʵ�ʹ����У�����Ӧ������������̬����ʽ�����ҷ�ӦҲ����һ�������ԣ����䷴Ӧԭ���ɱ�ʾΪ 2CH3OH��g����3O2��g��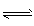 2CO2��g����4H2O��g������д���������·�Ӧ��ƽ�ⳣ����K��___________ �� �ڵ��Ե�ʹ�ù����У���ص��¶�������Ϊ����ԭ������ߣ����ж��¶�����ʱ�÷�Ӧ��ƽ�ⳣ����K��____________��������С�����䣩���䷴Ӧ������Ӧ���� ___________��������С�����䣩���¶�����_________�������������ڣ���ؽ���ѧ��ת��Ϊ���ܡ�
2CO2��g����4H2O��g������д���������·�Ӧ��ƽ�ⳣ����K��___________ �� �ڵ��Ե�ʹ�ù����У���ص��¶�������Ϊ����ԭ������ߣ����ж��¶�����ʱ�÷�Ӧ��ƽ�ⳣ����K��____________��������С�����䣩���䷴Ӧ������Ӧ���� ___________��������С�����䣩���¶�����_________�������������ڣ���ؽ���ѧ��ת��Ϊ���ܡ�
��1�����dz��õ�һ�ּ״�ȼ�ϵ�أ����Լ״��������ķ�ӦΪԭ����Ƶģ���������Һ��KOH��Һ��д���õ�ظ����ĵ缫��Ӧʽ_______________��
��2����ͼΪ���ñʼDZ��������ü״����ӽ���Ĥȼ�ϵ�صĽṹʾ��ͼ����װ����________���a����b����Ϊ��ص������� ��֪�κη�Ӧ������һ���Ŀ����ԡ��ü״����ӽ���Ĥȼ�ϵ����ʵ�ʹ����У�����Ӧ������������̬����ʽ�����ҷ�ӦҲ����һ�������ԣ����䷴Ӧԭ���ɱ�ʾΪ 2CH3OH��g����3O2��g��
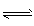 2CO2��g����4H2O��g������д���������·�Ӧ��ƽ�ⳣ����K��___________ �� �ڵ��Ե�ʹ�ù����У���ص��¶�������Ϊ����ԭ������ߣ����ж��¶�����ʱ�÷�Ӧ��ƽ�ⳣ����K��____________��������С�����䣩���䷴Ӧ������Ӧ���� ___________��������С�����䣩���¶�����_________�������������ڣ���ؽ���ѧ��ת��Ϊ���ܡ�
2CO2��g����4H2O��g������д���������·�Ӧ��ƽ�ⳣ����K��___________ �� �ڵ��Ե�ʹ�ù����У���ص��¶�������Ϊ����ԭ������ߣ����ж��¶�����ʱ�÷�Ӧ��ƽ�ⳣ����K��____________��������С�����䣩���䷴Ӧ������Ӧ���� ___________��������С�����䣩���¶�����_________�������������ڣ���ؽ���ѧ��ת��Ϊ���ܡ� 
��3����֪�ڳ��³�ѹ�£�
��2CH3OH(l)��3O2(g)===2CO2(g)��4H2O(g)����H1����1 275.6 kJ��mol��1
��2CO(g)��O2(g)===2CO2(g) ��H2����566.0 kJ��mol��1
��H2O(g)===H2O(l)����H3����44.0 kJ��mol��1
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��__________��
II��ij�¶��£����ܱ������г���2.0 mol CO��1.0mol H2O��������Ӧ��
CO��g��+H2O��g�� CO2��g��+H2��g���� CO��ת������ʱ��仯��ϵ��ͼ���ش��������⣺
CO2��g��+H2��g���� CO��ת������ʱ��仯��ϵ��ͼ���ش��������⣺
��2CH3OH(l)��3O2(g)===2CO2(g)��4H2O(g)����H1����1 275.6 kJ��mol��1
��2CO(g)��O2(g)===2CO2(g) ��H2����566.0 kJ��mol��1
��H2O(g)===H2O(l)����H3����44.0 kJ��mol��1
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��__________��
II��ij�¶��£����ܱ������г���2.0 mol CO��1.0mol H2O��������Ӧ��
CO��g��+H2O��g��
 CO2��g��+H2��g���� CO��ת������ʱ��仯��ϵ��ͼ���ش��������⣺
CO2��g��+H2��g���� CO��ת������ʱ��仯��ϵ��ͼ���ش��������⣺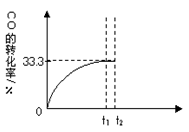
��4�����һ�����淴Ӧ��ƽ�ⳣ��Kֵ�ܴ�����˵����ȷ����_________������ĸ����
A���÷�Ӧ�ķ�Ӧ���Ϻ�ܲ��ȶ�
B���÷�Ӧһ���������ں̵ܶ�ʱ�������
C���÷�Ӧ��ϵ�ﵽƽ��ʱ������һ�ַ�Ӧ��İٷֺ�����С
D���÷�Ӧһ���Ƿ��ȷ�Ӧ
E���÷�Ӧʹ�ô������岻��
��5��t2ʱ����ƽ����ϵ����ͨ��1.0 mol H2O��g����t3ʱ�����½���ƽ�⣬����ԭ����ͼ�н��ı���һ������CO��ת���ʵı仯���Ʊ�ʾ����������ע���ٴν���ƽ���CO��ת���ʡ�
A���÷�Ӧ�ķ�Ӧ���Ϻ�ܲ��ȶ�
B���÷�Ӧһ���������ں̵ܶ�ʱ�������
C���÷�Ӧ��ϵ�ﵽƽ��ʱ������һ�ַ�Ӧ��İٷֺ�����С
D���÷�Ӧһ���Ƿ��ȷ�Ӧ
E���÷�Ӧʹ�ô������岻��
��5��t2ʱ����ƽ����ϵ����ͨ��1.0 mol H2O��g����t3ʱ�����½���ƽ�⣬����ԭ����ͼ�н��ı���һ������CO��ת���ʵı仯���Ʊ�ʾ����������ע���ٴν���ƽ���CO��ת���ʡ�
��1��CH3OH+8OH- 6e-=CO32- +6H2O
��2��b ��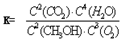 ����С ������ ������
����С ������ ������
��3��CH3OH(l)��O2(g)===CO(g)��2H2O(l) ��H����442.8 kJ��mol��1
��4��C
��5��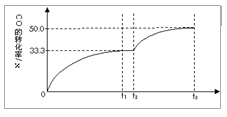
��2��b ��
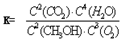 ����С ������ ������
����С ������ ������ ��3��CH3OH(l)��O2(g)===CO(g)��2H2O(l) ��H����442.8 kJ��mol��1
��4��C
��5��


��ϰ��ϵ�д�
 ��У����ϵ�д�
��У����ϵ�д�
�����Ŀ

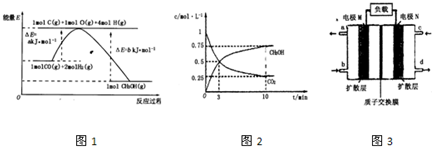
 ֱ�Ӽ״�ȼ�ϵ�أ�DNFC������Ϊ��21���͵綯������Ѻ�ѡ����Դ��
ֱ�Ӽ״�ȼ�ϵ�أ�DNFC������Ϊ��21���͵綯������Ѻ�ѡ����Դ��