题目内容
 直接甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.
直接甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.(1)101kPa时,1mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51kJ/mol,则甲醇燃烧的热化学方程式为
CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-726.51kJ/mol
| 3 |
| 2 |
CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-726.51kJ/mol
.| 3 |
| 2 |
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ?mol-1
②CH3OH(g)+
| 1 |
| 2 |
已知H2(g)+
| 1 |
| 2 |
则反应②的△H2=
-192.8kJ?mol-1
-192.8kJ?mol-1
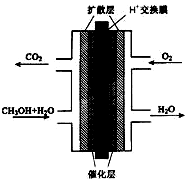
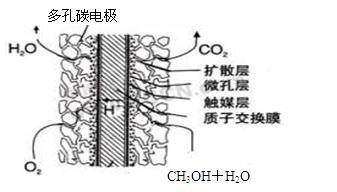
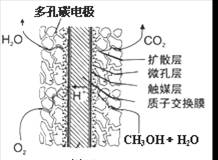
.(3)甲醇燃料电池的结构示意图如右.甲醇进入
负
负
极(填“正”或“负”),该极发生的电极反应为CH3OH+H2O-6e-=CO2+6H+
CH3OH+H2O-6e-=CO2+6H+
.(4)已知H-H键能为436kJ/mol,H-N键能为391kJ/mol,根据化学方程式:
N2(g)+3H2(g)=2NH3(g)△H=-92.4KJ/mol,则N≡N键的键能是
945.6KJ/mol
945.6KJ/mol
.分析:(1)1molCH3OH完全燃烧生成稳定的氧化物为气态二氧化碳和液态水,放出热量726.51kJ/mol,以此书写热化学方程式;
(2)由盖斯定律可知,①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ?mol-1、③H2(g)+
O2(g)═H2O(g)△H=-241.8kJ?mol-1,①+③得到反应②;
(3)甲醇燃料电池中,甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳;
(4)由N2(g)+3H2(g)=2NH3(g)△H=-92.4KJ/mol,反应热=断键吸收的能量之和-成键释放的能量之和.
(2)由盖斯定律可知,①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ?mol-1、③H2(g)+
| 1 |
| 2 |
(3)甲醇燃料电池中,甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳;
(4)由N2(g)+3H2(g)=2NH3(g)△H=-92.4KJ/mol,反应热=断键吸收的能量之和-成键释放的能量之和.
解答:解:(1)1molCH3OH完全燃烧生成稳定的氧化物为气态二氧化碳和液态水,放出热量726.51kJ/mol,则燃烧的热化学方程式为CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-726.51kJ/mol,
故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-726.51kJ/mol;
(2)由盖斯定律可知,①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ?mol-1、③H2(g)+
O2(g)═H2O(g)△H=-241.8kJ?mol-1,①+③得到反应②,
则△H2=+49.0kJ?mol-1+(-241.8kJ?mol-1)=-192.8kJ?mol-1,故答案为:-192.8kJ?mol-1;
(3)甲醇燃料电池中,甲醇中C元素的化合价升高,则甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳,电极反应为CH3OH+H2O-6e-=CO2+6H+,
故答案为:负;CH3OH+H2O-6e-=CO2+6H+;
(4)由N2(g)+3H2(g)=2NH3(g)△H=-92.4KJ/mol,反应热=断键吸收的能量之和-成键释放的能量之和,设N≡N键的键能为x,则
x+436KJ/mol×3-6×391KJ/mol=-92.4KJ/mol,解得x=945.6KJ/mol,故答案为:945.6KJ/mol.
| 3 |
| 2 |
故答案为:CH3OH(l)+
| 3 |
| 2 |
(2)由盖斯定律可知,①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ?mol-1、③H2(g)+
| 1 |
| 2 |
则△H2=+49.0kJ?mol-1+(-241.8kJ?mol-1)=-192.8kJ?mol-1,故答案为:-192.8kJ?mol-1;
(3)甲醇燃料电池中,甲醇中C元素的化合价升高,则甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳,电极反应为CH3OH+H2O-6e-=CO2+6H+,
故答案为:负;CH3OH+H2O-6e-=CO2+6H+;
(4)由N2(g)+3H2(g)=2NH3(g)△H=-92.4KJ/mol,反应热=断键吸收的能量之和-成键释放的能量之和,设N≡N键的键能为x,则
x+436KJ/mol×3-6×391KJ/mol=-92.4KJ/mol,解得x=945.6KJ/mol,故答案为:945.6KJ/mol.
点评:本题为综合题,涉及反应热的计算、热化学反应方程式的书写、燃料电池等知识点,注重高考常考考点的考查,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
 CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图所示:
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图所示: