��Ŀ����
�״��ǻ����л�����ԭ�Ϻ��������ȼ�ϣ��㷺�����������ȼ�ϵ�أ���ҵ���Լ����ˮ����Ϊԭ���Ʊ��״�����Ӧ�������£�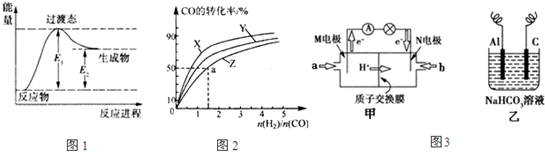
��Ӧ��CH4��g��+H2O��g��?CO��g��+3H2��g����H1
��Ӧ��CO��g��+2H2��g��?CH3OH��g����H2 ����H2��0=
��1��ͼ1�Ƿ�Ӧ����й����е������仯ʾ��ͼ������ͼ���жϣ������¶ȣ���ӦI��ƽ�ⳣ����
��2����֪�ڴ�����һ��ѹǿ�£���Ӧ�����Է����У����ݻ�Ϊ1L�ĺ��������У��ֱ��о���230�桢250���270�������¶��ºϳɼ״��Ĺ��ɣ�
ͼ2�����������¶��²�ͬ��H2��CO����ʼ��ɱȣ���ʼʱCO�����ʵ�����Ϊ1mol����COƽ��ת���ʵĹ�ϵ��������Z��Ӧ���¶���
��3��ͼ3����һ�ּ״�ȼ�ϵ�صĽṹʾ��ͼ���״��ṩ���Ӻ͵��ӣ����Ӿ����·������һ����������Ӧ������ܷ�ӦΪ2CH3OH+3O2
| ||
��M�缫�ĵ缫��ӦʽΪ
���������������Դ����ͼ3����ʾװ�ã���ʵ������ģ������Ʒ���桰�ۻ��������Ĺ����У�����Al�缫��������Dz��������ݳ���ԭ���ǣ������ӷ���ʽ��ʾ����
��4���ϳɼ״�ʱ��ѡ��CuClΪ������CuCl�Dz�����ˮ�İ�ɫ���壬�Ʊ�ʱ��CuCl2��Һ�м������ͭ�ۣ�������ӦCuCl2+Cu�T2CuCl����ʵ�������Ӧ�ȼ���Ũ���ᣬ������ӦCuCl+HCl?H[CuCl2]����Ӧ��������Һ��������ˮ����CuCl���ɣ�ʵ������м���Ũ�����Ŀ����
��������1���������ȷ�Ӧ���¶�Խ�ߣ���ѧ��Ӧ��KԽ��
��2���ϳɼ״��ķ�Ӧ�Ƿ��ȷ�Ӧ���¶����ߣ�ת���ʽ��ͣ�����ƽ�ⳣ������ʽ��һ����̼��ת�������㣻
��3����ȼ�ϵ���У�������ȼ�Ϸ���ʧ���ӵ�������Ӧ�����������������õ��ӵĻ�ԭ��Ӧ�������ӴӸ����������������ݵ��صĹ���ԭ����˫ˮ��ԭ��֪ʶ���ش�
��4������Ũ���ᷢ���ķ�Ӧ���ƽ���ƶ�ԭ�������ͣ�����CuCl��Ksp=c��Cu+��?c��Cl-��������ش�
��2���ϳɼ״��ķ�Ӧ�Ƿ��ȷ�Ӧ���¶����ߣ�ת���ʽ��ͣ�����ƽ�ⳣ������ʽ��һ����̼��ת�������㣻
��3����ȼ�ϵ���У�������ȼ�Ϸ���ʧ���ӵ�������Ӧ�����������������õ��ӵĻ�ԭ��Ӧ�������ӴӸ����������������ݵ��صĹ���ԭ����˫ˮ��ԭ��֪ʶ���ش�
��4������Ũ���ᷢ���ķ�Ӧ���ƽ���ƶ�ԭ�������ͣ�����CuCl��Ksp=c��Cu+��?c��Cl-��������ش�
����⣺��1������ͼһ֪������Ӧ���������������������������Ը÷�Ӧ�����ȵģ��¶�Խ�ߣ�KԽ�ʴ�Ϊ������
��2�����ݷ�ӦCO��g��+2H2��g��?CH3OH��g����H1=-116kJ?mol-1���Ƿ��ȷ�Ӧ���¶�Խ�ߣ�ת����Խ�ͣ���������Z��Ӧ���¶���270�棬
�ʴ��ǣ�270�棻
�ڸ÷�Ӧ��ƽ�ⳣ��K=
��a��ʱ��COת����50%����Ӧ������2mol��50%=1molCO����������2mol��ʣ��1molCO��n��H2��=3mol-2mol=1mol������1mol�״���a�����ֵ�Ũ���ǣ�c��CH3OH��=
=0.5mol/L��c��CO��=
=0.5mol/L��0.5mol/L��c��H2��=
=0.5mol/L���������ʽ�ã�K=
=4L2?mol-2��
�ʴ��ǣ�270�棻4L2?mol-2��
��3������ȼ�ϵ���У������ӴӸ�����������������M�缫�Ǹ�����N�缫����������������ȼ�Ϸ���ʧ���ӵ�������Ӧ������CH3OH+H2O-6e-=CO2+6H+��
�ʴ�Ϊ��CH3OH+H2O-6e-=CO2+6H+��
���ڵ����У�������Ϊ�������͵�Դ��������ӣ�ȼ�ϵ�ص�������ͨ�����ĵ缫������N��������Al�������缫��Ӧ��Al-3e-=Al3+�������ӻ��̼���������֮�䷢��˫ˮ�ⷴӦ�����������������Ͷ�����̼����Al3++3HCO3-=Al��OH��3��+3CO2������Һ����ǣ��ʴ�Ϊ��Al+3HCO3--3e-=Al��OH��3��+3CO2����N��
��4���Ʊ�CuClʱ����CuCl2��Һ�м������ͭ�ۣ�������ӦCuCl2+Cu�T2CuCl����ʵ�������Ӧ�ȼ���Ũ���ᣬ������ӦCuCl+HCl?H[CuCl2]���ɴ˿ɼ�����Ũ������Դ�ʹƽ�������ƶ����������Է�ֹCuCl���帲����Cu���棬Ӱ�췴Ӧ�Ľ��У�CuCl��Ksp=c��Cu+��?c��Cl-������
=
8.5��10-5mol/L���ʴ�Ϊ����ʹƽ�������ƶ�����ֹCuCl���帲����Cu���棬Ӱ�췴Ӧ�Ľ��У�8.5��10-5��
��2�����ݷ�ӦCO��g��+2H2��g��?CH3OH��g����H1=-116kJ?mol-1���Ƿ��ȷ�Ӧ���¶�Խ�ߣ�ת����Խ�ͣ���������Z��Ӧ���¶���270�棬
�ʴ��ǣ�270�棻
�ڸ÷�Ӧ��ƽ�ⳣ��K=
| c(CH3OH) |
| c(CO)?c2(H2) |
| 1mol |
| 2L |
| 1mol |
| 2L |
| 1mol |
| 2L |
| 0.5mol?L-1 |
| 0.5mol?L-1��(0.5mol?L-1)2 |
�ʴ��ǣ�270�棻4L2?mol-2��
��3������ȼ�ϵ���У������ӴӸ�����������������M�缫�Ǹ�����N�缫����������������ȼ�Ϸ���ʧ���ӵ�������Ӧ������CH3OH+H2O-6e-=CO2+6H+��
�ʴ�Ϊ��CH3OH+H2O-6e-=CO2+6H+��
���ڵ����У�������Ϊ�������͵�Դ��������ӣ�ȼ�ϵ�ص�������ͨ�����ĵ缫������N��������Al�������缫��Ӧ��Al-3e-=Al3+�������ӻ��̼���������֮�䷢��˫ˮ�ⷴӦ�����������������Ͷ�����̼����Al3++3HCO3-=Al��OH��3��+3CO2������Һ����ǣ��ʴ�Ϊ��Al+3HCO3--3e-=Al��OH��3��+3CO2����N��
��4���Ʊ�CuClʱ����CuCl2��Һ�м������ͭ�ۣ�������ӦCuCl2+Cu�T2CuCl����ʵ�������Ӧ�ȼ���Ũ���ᣬ������ӦCuCl+HCl?H[CuCl2]���ɴ˿ɼ�����Ũ������Դ�ʹƽ�������ƶ����������Է�ֹCuCl���帲����Cu���棬Ӱ�췴Ӧ�Ľ��У�CuCl��Ksp=c��Cu+��?c��Cl-������
| Ksp |
| c(Cl-) |
| 1.7��10-7 |
| 2��10-3 |
�����������漰�绯ѧ���Ȼ�ѧ�Լ���ѧ��Ӧ���ʺ�ƽ����ۺ�֪ʶ�Ŀ��飬ע��֪ʶ�Ĺ��ɺ������ǹؼ����ѶȽϴ�

��ϰ��ϵ�д�
 ȫ�ܲ��һ���þ�ϵ�д�
ȫ�ܲ��һ���þ�ϵ�д�
�����Ŀ
 CO(g)+3H2(g) ��H1
CO(g)+3H2(g) ��H1  CH3OH(g) ��H2
CH3OH(g) ��H2 
 2CO2+4H2O��
2CO2+4H2O��