题目内容
16.由一种阳离子和两种酸根离子组成的盐称混盐.下列关于混盐Na4S2O3的有关判断,不正确的是( )| A. | 该混盐水溶液呈碱性 | |
| B. | 该混盐与H2SO4反应有气体生成 | |
| C. | 该混盐溶液加入BaCl2可以生成白色沉淀 | |
| D. | 该混盐在酸性条件下可生成S,每产生32g S转移2NA个电子 |
分析 混盐Na4S2O3中S元素的平均化合价为+1价,应为Na2SO3和Na2S的混盐,Na2SO3和Na2S都是强碱弱酸盐,溶液呈碱性,在酸性条件下可发生氧化还原反应:SO32-+2S2-+6H+=3S↓+3H2O,据此解答.
解答 解:A.混Na4S2O3为Na2SO3和Na2S的混盐,Na2SO3和Na2S都是强碱弱酸盐,溶液呈碱性,故A正确;
B.亚硫酸、硫化氢酸性弱于硫酸,所以该混盐与H2SO4反应可生成SO2或H2S气体,故B正确;
C.该混盐溶液加入BaCl2可以生成BaSO3白色沉淀,故C正确;
D.在酸性条件下可发生:SO32-+2S2-+6H+=3S↓+3H2O,生成3molS转移电子4mol,则每产生32g S即1molS转移$\frac{4}{3}$NA个电子,故D错误;
故选:D.
点评 本题考查了物质的性质,明确混盐Na4S2O3的组成是解题关键,注意亚硫酸盐、硫离子的性质,题目难度中等.

练习册系列答案
相关题目
6.下列对原电池的分析不正确的是( )
| A. | 由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+ | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O | |
| C. | 由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ | |
| D. | 由Al、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
7.已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.请回答下列问题:
(1)元素A简单氢化物中A原子的杂化类型是sp3,B、C、D的电负性由小到大的顺序为Na<Cl<F(用所对应的元素符号表示).C的气态氢化物易溶于水的原因是:HF和H2O分子之间能形成氢键.
(2)比E少5个质子的原子基态电子排布式为1s22s22p63s23p63d54s1或〔Ar〕3d54s1.元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图1中的a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为2:1.
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似
(如图2所示),其中3种离子晶体的晶格能数据如表:
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:TiN>MgO>CaO>KCl.
(4)温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.若有1mol CH4生成,则有6mol σ键和2mol π键断裂.
(5)铜是第四周期最重要的过度元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如图3所示,若
CuH的密度为d g•cm-3,阿伏加德罗常数的数值为NA,则Cu+与H-的核间距为$\frac{\sqrt{3}}{4}×$$\root{3}{\frac{65×4}{d{N}_{A}}}$cm(用含d和NA的代数式表示).
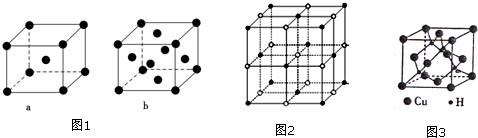
(1)元素A简单氢化物中A原子的杂化类型是sp3,B、C、D的电负性由小到大的顺序为Na<Cl<F(用所对应的元素符号表示).C的气态氢化物易溶于水的原因是:HF和H2O分子之间能形成氢键.
(2)比E少5个质子的原子基态电子排布式为1s22s22p63s23p63d54s1或〔Ar〕3d54s1.元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图1中的a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为2:1.
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似
(如图2所示),其中3种离子晶体的晶格能数据如表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
(4)温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.若有1mol CH4生成,则有6mol σ键和2mol π键断裂.
(5)铜是第四周期最重要的过度元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如图3所示,若
CuH的密度为d g•cm-3,阿伏加德罗常数的数值为NA,则Cu+与H-的核间距为$\frac{\sqrt{3}}{4}×$$\root{3}{\frac{65×4}{d{N}_{A}}}$cm(用含d和NA的代数式表示).

11.鼠尾草酚用于防治骨质疏松,鼠尾草酸可两步转化得到鼠尾草酚,下列说法正确的是( )

| A. | X、Y、Z属于芳香族化合物 | |
| B. | X、Y、Z均能与FeCl3溶液发生显色反应 | |
| C. | 1 mol X或1mol Z与NaOH溶液反应,均最多消耗3molNaOH | |
| D. | X、Y、Z均能与溴的四氯化碳溶液发生加成反应 |
8.下列叙述中错误的是( )
| A. | 用水可以鉴别乙醇、苯、和溴苯 | |
| B. | 甲苯与氯气在光照下可发生取代反应,主要生成2,4-二氯甲苯 | |
| C. | 化学式为C7H16的有机物,分子中含有3个甲基的可能结构有3种 | |
| D. | 乙酸丁酯中含乙酸杂质,可以加入饱和碳酸钠溶液洗涤,然后通过分液来去除杂质 |
5.下列有关物质性质的说法错误的是( )
| A. | 热稳定性:HCl>H2S | B. | 原子半径:N>O | ||
| C. | 结合质子能力:S2->Cl- | D. | 酸性:H2SO3>H2SO4 |


 .
. .
.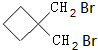 +CH2(COOC2H5)2+2C2H5ONa→
+CH2(COOC2H5)2+2C2H5ONa→ +2NaBr+2C2H5OH.
+2NaBr+2C2H5OH. .
.