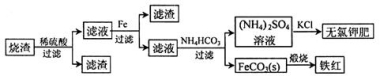
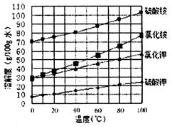
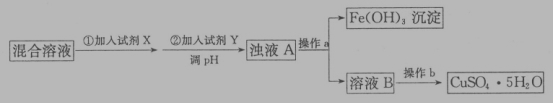
题目内容
14.在浓度均为4mol•L-1的盐酸和硫酸各100mL溶液中,分别加入等质量的铁粉,充分反应后生成气体体积比为2:3,则加入铁粉的质量是( )| A. | 11.2g | B. | 8.4g | C. | 16.8g | D. | 22.4g |
分析 发生反应为:Fe+2HCl═FeCl2+H2↑①、Fe+H2SO4═FeSO4+H2↑②,加入铁粉质量相等,如果对于这两个反应都是铁不足,则Fe完全反应,生成气体体积之比为1:1,若酸都不足,则酸完全反应,根据方程式可知,生成的气体体积之比为1:2,而实际气体体积之比为2:3,所以肯定是铁对一个反应来说是不足,对于另一个反应是过量.通过方程式可以看出来,铁消耗HCl多,对于①反应来说是盐酸不足,可以算出来生成H2物质的量,根据体积比可算出来②反应生成n(H2),对于②反应是Fe不足,以此计算铁的质量.
解答 解:发生反应为:Fe+2HCl═FeCl2+H2↑①、Fe+H2SO4═FeSO4+H2↑②,加入铁粉质量相等,
如果对于这两个反应都是铁不足,则Fe完全反应,生成气体体积之比为1:1,
若酸都不足,则酸完全反应,根据方程式可知,生成的气体体积之比为1:2,
而实际气体体积之比为1:2,所以肯定是铁对一个反应来说是不足,对于另一个反应是过量.通过方程式可以看出来,铁消耗HCl多,对于①反应来说是盐酸不足,对于②反应是Fe不足,
HCl的物质的量为0.1L×4mol/L=0.4mol,由Fe+2HCl═FeCl2+H2↑,可知生成气体的物质的量为0.4mol×$\frac{1}{2}$=0.2mol,
所以由硫酸生成的气体的物质的量为0.2mol×$\frac{3}{2}$=0.3mol,
设铁的质量为x,则:
Fe+H2SO4═FeSO4+H2↑
56g 1mol
x 0.3mol
所以,56g:x=1mol:0.3mol,解得x=16.8g,
故选C.
点评 本题考查化学方程式的计算,关键利用生成氢气的体积关系、结合反应方程式判断反应的过量问题,侧重分析与计算能力的考查,题目难度不大.

| A. | X、Y元素能与氢形成分子式为H2XY2、H4X2Y2等弱酸 | |
| B. | 化合物ZY2中只含有离子键 | |
| C. | 工业上可用X单质置换ZY得到Z单质 | |
| D. | Y的氢化物的沸点比其下一周期的同族元素的氢化物的沸点低 |
| A. | Na2CO3固体(NaHCO3) 加热 | B. | I2(沙子) 加热 | ||
| C. | Na2O2(Na2O) 氧气中加热 | D. | Cl2(HCl) 通过NaOH溶液 |
| A. | Be、C、B | B. | Li、O、Cl | C. | Al、S、Si | D. | C、S、Mg |
| A. | 元素R位于周期表中第ⅦA族 | |
| B. | RO3-中的R只能被还原 | |
| C. | R2在常温常压下一定是气体 | |
| D. | 若1 mol RO3-参与该反应,则转移电子的物质的量为6 mol |