题目内容
【题目】“分子筛”是一种具有多孔结构的铝硅酸盐(NaAlSiO4·nH2O),其中有许多笼状孔穴和通道,能让直径比孔穴小的分子通过而将大的分子留在外面,故此得名。利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备“分子筛”的一种工艺流程如下:
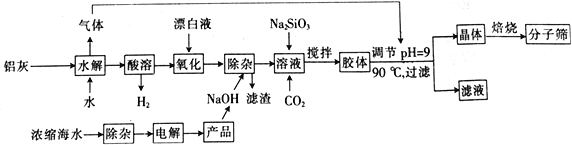
(1)“分子筛”的化学式用氧化物形式可表示为_______________。
(2)铝灰水解产生的气体为________(填化学式);“水解”在加热条件下而不在室温下进行的原因是________________________。
(3)“酸溶”时,发生氧化还原反应的离子方程式为_________________________________。
(4)该工艺中滤渣的颜色为________________________。
(5)某学习小组设计实验模拟从浓缩海水(含Ca2+、Mg2+、SO42-)中提取试剂级NaCl:
![]()
①实验中若向浓缩海水中加入的是Na2CO3浓溶液,则有难溶的Mg2(OH)2CO3生成,同时有气体逸出。该反应的离子方程式为__________________________________。
②该学习小组发现上述实验即使BaCl2用量不足,第Ⅲ步沉淀中依然含有少量BaCO3。从平衡角度分析其原因:_____________________________________________。
【答案】Na2O·Al2O3·2SiO2·2nH2O NH3加快AlN水解反应速率,降低NH3在水中的溶解度,促使NH3逸出2Al+6H+=2Al3++3H2↑红褐色2CO32-+2Mg2++H2O=Mg2(OH)2CO3↓+CO2↑加入的CO32-使BaSO4的沉淀溶解平衡向溶解方向移动,从而形成BaCO3
【解析】
(1)硅酸盐写成氧化物形式时,写氧化物顺序是:活泼金属氧化物、较活泼金属氧化物、二氧化硅、水,要注意原子守恒;(2)铝灰中AlN水解为氢氧化铝和氨气;加热可以加快AlN水解反应速率,降低NH3在水中的溶解度;(3)“酸溶”时,铝与酸的反应属于氧化还原反应;(4)“酸溶”后的液体氧化后含有Al3+、Fe3+,加入过量的氢氧化钠后生成偏铝酸钠和氢氧化铁沉淀;(5)①实验中若向浓缩海水中加入的是Na2CO3浓溶液,有难溶的Mg2(OH)2CO3生成,同时有气体二氧化碳溢出;②根据沉淀溶解平衡移动方向分析;
(1)硅酸盐写成氧化物形式时,写氧化物顺序是:活泼金属氧化物、较活泼金属氧化物、二氧化硅、水,所以分子筛可表示式为:![]() ;(2)铝灰中AlN水解为氢氧化铝和氨气,所以铝灰水解产生的气体为NH3;加热可以加快AlN水解反应速率,降低NH3在水中的溶解度,所以“水解”在加热条件下进行;(3)“酸溶”时,铝与酸的反应属于氧化还原反应,反应离子方程式是2Al+6H+=2Al3++3H2↑;(4)“酸溶”后的液体氧化后含有Al3+、Fe3+,加入过量的氢氧化钠后生成偏铝酸钠和氢氧化铁沉淀,滤渣是氢氧化铁,颜色为红褐色;(5)①实验中若向浓缩海水中加入的是Na2CO3浓溶液,有难溶的Mg2(OH)2CO3生成,同时有气体二氧化碳溢出,反应方程式是2CO32-+2Mg2++H2O=Mg2(OH)2CO3↓+CO2↑;②加入的CO32-使BaSO4的沉淀溶解平衡向溶解方向移动,从而形成BaCO3,所以即使BaCl2用量不足,第Ⅲ步沉淀中依然含有少量BaCO3。
;(2)铝灰中AlN水解为氢氧化铝和氨气,所以铝灰水解产生的气体为NH3;加热可以加快AlN水解反应速率,降低NH3在水中的溶解度,所以“水解”在加热条件下进行;(3)“酸溶”时,铝与酸的反应属于氧化还原反应,反应离子方程式是2Al+6H+=2Al3++3H2↑;(4)“酸溶”后的液体氧化后含有Al3+、Fe3+,加入过量的氢氧化钠后生成偏铝酸钠和氢氧化铁沉淀,滤渣是氢氧化铁,颜色为红褐色;(5)①实验中若向浓缩海水中加入的是Na2CO3浓溶液,有难溶的Mg2(OH)2CO3生成,同时有气体二氧化碳溢出,反应方程式是2CO32-+2Mg2++H2O=Mg2(OH)2CO3↓+CO2↑;②加入的CO32-使BaSO4的沉淀溶解平衡向溶解方向移动,从而形成BaCO3,所以即使BaCl2用量不足,第Ⅲ步沉淀中依然含有少量BaCO3。