题目内容
在恒温恒压条件下,向可变的密闭容器中充人3LA和2LB发生如下反应3A(g)+2B(g) xC(g)+yD(g),达到平衡时C的体积分数为m%.若维持温度不变,将0.6LA、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%.则x、y的值分别为
xC(g)+yD(g),达到平衡时C的体积分数为m%.若维持温度不变,将0.6LA、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%.则x、y的值分别为
[ ]
A.x=3、y=1
B.x=10、y=2
C.x=5、y=1
D.x=2、y=3
答案:C
提示:
提示:
|
该反应起始反应物的量之比为 0.6∶0.4=3∶2,符合化学方程式中反应物的系数比,若4LC、0.8LD恰好完全转化成A、B时,必须满足x∶y=5∶1,但此时x+y≠2+3,故在恒温恒压条件下,符合x∶y=5∶1的所有x、y的值不一定均符合题意.若4LC、0.8LD不能恰好完全转化成A、B时,则不能达到与开始时等效的平衡状态.当x=5、y=1时,用极端假设法“4LC、0.8LD”可转化为“2.4LA、1.6LB”,反应物的起始量相当于“3LA、2LB”,与原起始量相同,能达到与开始时相同的平衡状态. |

练习册系列答案
相关题目
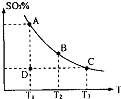 (1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
(1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题: xC(g)+yD(g),达到平衡时C的体积分数为m%.若维持温度不变,将0.6LA、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%.则x、y的值分别为
xC(g)+yD(g),达到平衡时C的体积分数为m%.若维持温度不变,将0.6LA、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%.则x、y的值分别为