题目内容
如下图所示,将6 mol X和3 mol Y混合气体置于体积可变的等压容器中,在一定温度下发生如下反应:2X(g)+Y(g)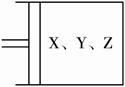
(1)达平衡状态A时,Y的转化率为________,向达到平衡状态A的容器中通入少量Y,体系中X的体积分数_________(填“增大”或“减小”或“不变”)。?
(2)若起始时a=3.2 mol,且达到平衡后各气体的体积分数与平衡状态A相同,则起始时b、c的取值分别为_________。?
(3)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态A相同,则起始时c的取值范围是_________。
(1)80% 减小?
(2)b=1.6 mol,c为任意值?
(3)4.8 mol<c≤6mol?
解析:(1)设有2a mol的X参加反应,则有?
2X + Y ![]() 2Z?
2Z?
反应前: 6 mol 3 mol 0
转化了: 2a mol a mol 2a mol?
反应后:(6-2a) mol (3-a) mol 2a mol?
已知:(6-2a)+(3-a)+2a=6.6?
化简:9-a=6.6 得a=2.4?
所以Y的转化率=![]() ×100%=80%?
×100%=80%?
另:通入少量Y后,根据勒夏特列原理,平衡向正反应方向移动,必然消耗一定量的X气体。又根据外界影响占主要,平衡移动占次要,反应后混合气体的体积必然要比原平衡态大。因此X的体积分数=![]() 必然减小。
必然减小。
(2)只需让a∶b保持原来的比例2∶1,而c的值则是任意值,因为无论c为多大都相当于加入2份X和1份Y。
(3)通过(1)计算知达平衡时n(X)=1.2 mol,n(Y)=0.6 mol, n(Z)=4.8 mol,因此只需让c>4.8 mol平衡即可向逆反应方向进行。而要使达到平衡后各气体的物质的量与平衡状态A相同,必有c≤6 mol。

 综合自测系列答案
综合自测系列答案
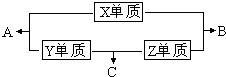 X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化: 硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:

 A2O4(g);△H<0.在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示.
A2O4(g);△H<0.在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示.