题目内容
从化工厂铬渣中提取硫酸钠的工艺如下: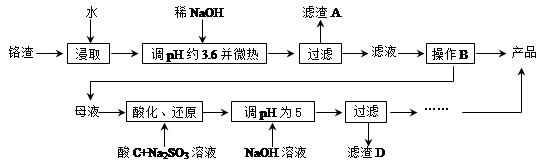
已知:①铬渣含有Na2SO4及少量Cr2O72-、Fe3+;②Fe3+、Cr3+完全沉淀(c ≤1.0×10-5 mol·L-1)时pH分别为3.6和5。
(1)“微热”除能加快反应速率外,同时还可以 ,滤渣A为 (填化学式)。
(2)根据溶解度(S)∽温度(T)曲线,操作B的最佳方法为 (填字母序号)
A.蒸发浓缩,趁热过滤
B.蒸发浓缩,降温结晶,过滤
(3)酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为: ;酸C为 ,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]= 。
(4)根据2CrO42-+2H+  Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。
Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。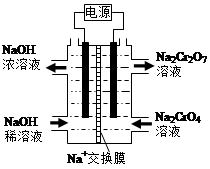
(1)促进Fe3+水解生成Fe(OH)3而除去;(2分)Fe(OH)3;(2分)
(2)A(2分)
(3)3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;(3分,化学式和配平错误0分)
H2SO4;(2分)1.0×10-32 mol4·L-4(2分,不带单位扣1分)
(4)正极,(2分)4OH--4e-=O2↑+2H2O(2分)(无“↑”扣分1分)
解析试题分析:(1)盐类的水解反应为吸热反应,所以微热能促进Fe3+水解生成Fe(OH)3而除去;Fe3+水解生成Fe(OH)3沉淀,所以滤渣A为Fe(OH)3。
(2)根据溶解度(S)∽温度(T)曲线,可以看出温度较高时,随着温度的升高,Na2SO4的溶解度逐渐减小,所以采用蒸发浓缩,趁热过滤的方法,故A项正确。
(3)酸化后Cr2O72-把SO32-氧化为SO42?,所以离子方程式为:3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;因为最终产品为Na2SO4,为避免产生杂质,酸C为H2SO4;恰好完全沉淀时离子浓度为1.0×10-5 mol·L-1,Cr3+完全沉淀时pH为5,c(OH?)= 1.0×10-9 mol·L-1,所以Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=c(Cr3+)?c3(OH?)= 1.0×10-5 mol·L-1×(1.0×10-9 mol·L-1)3=1.0×10-32 mol4·L-4。
(4)根据示意图,图中右侧Na2CrO4转化为Na2Cr2O7,需要H+,说明右侧电极发生H2O电离产生的OH?放电,使H2O的电离平衡向右移动,H+增多,所以右侧电极连接电源的正极,电极方程式为:4OH--4e-=O2↑+2H2O
考点:本题考查化学工艺流程分析、晶体结晶、离子方程式的书写、溶度积常数的计算、电解原理及应用。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案下列常用的混合物分离或提纯操作中,需使用冷凝器的是
| A.过滤 | B.蒸发 | C.蒸馏 | D.分液 |
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
已知:① NaFeO2遇水强烈水解。
② Cr2O72-+ H2O 2CrO42-+ 2H+
2CrO42-+ 2H+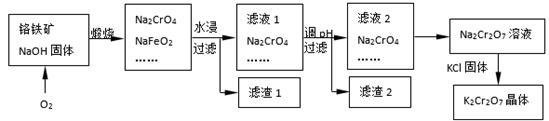
(1)K2Cr2O7中Cr元素的化合价是 。
(2)滤液1的成分除Na2CrO4、Na2SiO3外,还含有(填化学式) ;
生成滤渣1中红褐色物质反应的化学方程式是。
(3)由滤液2转化为Na2Cr2O7溶液应采取的措施是。
(4)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。
(5)莫尔法是一种沉淀滴定法,以Na2CrO4 为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.34×10-6 | 7.1×10-7 | 1.1×10-8 | 6.5×10-5 | 1.0×10-6 |
①滴定终点的现象是。
②若用AgNO3溶液滴定NaSCN溶液,可选为滴定指示剂的是(选填编号)
A.NaCl B.K2CrO4 C.BaBr2
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下: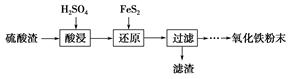
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率;②________。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42—,该反应的离子方程式为________________________________________________________________________。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入稀盐酸、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应的化学方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62—
Sn2++4Cl-+2HgCl2=SnCl62—+Hg2Cl2↓
6Fe2++Cr2O72—+14H+=6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量________(填“偏高”、“偏低”或“不变”,下同);
②若不加HgCl2,则测定的Fe3+量________。
(4)①可选用________(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是________________________________________________________________________(用离子方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀硝酸、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。
请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化:________________________________________________________;
b.沉淀:__________________________________________________________;
c.分离,洗涤;
d.烘干,研磨。