��Ŀ����
����Ŀ����������ȵ���Ƭ��ͭƬ�õ�����������500 mL����ͭ��Һ�й�����ͼ1��װ�ã�

�����¾����跴Ӧ��������Һ������䣩��
��1����Ƭ�ϵĵ缫��ӦʽΪ______________��ͭƬ��Χ��Һ�����___________������
��2����2 min������Ƭ��ͭƬ֮���������Ϊ1.2 g�����㣺�����������ĵ��ӵ����ʵ���Ϊ_________________mol��
��3�������ĵ绯ѧ��ʴ�ı������γ���ԭ��ء�����ͼ��ʾ���ձ��ж�ʢ��ϡ���ᡣ

��ͼ2 B�е�SnΪ________����Sn��������Һ��pH��������С�䣩___________��
��ͼ2 C�б���ʴ�Ľ�����___________���Ƚ�A��B��C�д�������ʴ�������ɿ쵽����˳����______��
��4������Ӧ��ԭ���ԭ�������˶��ֵ�أ������㲻ͬ����Ҫ��ȼ�ϵ����һ�ָ�Ч�������ѺõĹ���װ�ã���ͼ�ǵ����Ϊϡ������Һ������ȼ�ϵ��ԭ��ʾ��ͼ���ش��������⣺
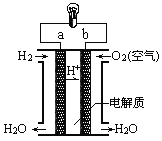
������ȼ�ϵ�ص��ܷ�Ӧ��ѧ����ʽ�ǣ�___________________��
����ع���һ��ʱ���������Һ��Ũ��_____________���������С�����䡱����
���𰸡���1��Fe-2e-=Fe2+ ��ɫ��dz
��2��0.02 ��3���� ��� п��Zn�� BAC ��4��2H2+O2=2H2O ��С
����������1�����Ľ�����ǿ��ͭ�����Ǹ������缫��ӦʽΪ Fe-2e-=Fe2+��ͭ����������Һ�е�ͭ�����ŵ磬ͭ����Ũ�ȼ�С�����ʵ����������Һ��ɫ��dz��
��2������ͭ���ã���Ϊԭ��صĸ��������ӴӸ�����������ת��x mol���ӣ�������0.5x mol Fe������ 0.5x mol Cu������0.5x����64+56��=1.2��x=0.02��
��3����ͼ2 B�е�Sn�Ľ�������������SnΪ��������Һ�������ӷŵ磬������Ũ�ȼ�С����Sn��������Һ��pH�����A������ѧ��ʴ��B��FeΪ������SnΪ������Fe����ʴ��C��ZnΪ������FeΪ������Fe����������A��B��C��������ʴ�����ʣ��ɿ쵽����˳����B��A��C��
��4��������ȼ�ϵ�ص��ܷ�Ӧ��������ȼ�շ�Ӧ������ѧ����ʽ��2H2+O2=2H2O������ع���һ��ʱ���������ˮ���ɣ��ܼ����ӣ�����������Һ��Ũ�ȼ�С��
