题目内容
【题目】2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图所示)可用于ⅢB族元素对应的离子萃取,如La2+、Sc2+。写出基态二价钪离子(Sc2+)核外电子排布式:__________。其中电子占据的轨道数为__________个。
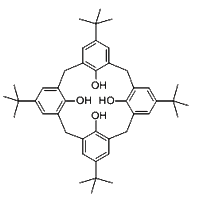
(2)对叔丁基杯[4]芳烃由4个烃基构成杯底,其中条件氧原子的杂化方式为___________。烃基间的相互作用力为_______________。
(3)不同大小的杯芳烃能识别某些离子,如:N3-、SCN-等。根据等电子体原料判断N3-空间构型为______;一定条件下,SCN-与MnO2反应可得到(SCN)2。试写出(SCN)2 的结构式:_______________。
(4)已知C60分子结构和C60晶胞示意图(如图Ⅱ,图Ⅲ所示):
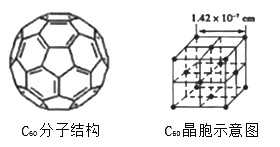
则一个C60分子中含有σ键个数为__________,与每个C60分子距离最近且相等的C60分子有_________个,C60晶体的密度为__________(计算结果保留两位小数)。
【答案】 1s22s22p63s23p63d1或[Ar]3d1 10 sp3 氢键 直线型 N≡C-S-S-C≡N 90 12 1.67g/cm3
【解析】本题考查选修三《物质结构与性质》,从基础知识入手,(1)Sc是21号元素,核外电子排布式为[Ar]3d14s2,则Sc2+的电子排布式为1s22s22p63s23p63d1或[Ar]3d1 ;s能级有1个轨道,p能级有3个轨道,d能级只有1个电子,占有1个轨道,因此电子占据的轨道有10个;(2)羟基中的氧原子,有2个σ键,2个孤电子对,因此杂化类型是sp3,羟基键通过氢键联系到一起;(3)N3-Y与CO2互为等电子体,因此N3-的空间构型为直线型;(SCN)2的结构式为N≡C-S-S-C≡N ;(4)根据C60分子结构,C60分子中1个碳原子有2个C-C键、1个"C=C",根据均摊法,一个碳原子真正含有的σ键的个数为3/2,即一个C60分子中含有σ键的个数为60×3/2=90;根据C60晶胞结构,离C60最近的C60上面有4个,中间有4个,下面有4个,即有12个;C60的个数为8×1/8+6×1/2=4,晶胞的质量为4×720/NAg,晶胞的体积为(1.42×10-7)3cm3,根据密度的定义,晶胞的密度等于为4×720/[NA×(1.42×10-7)3]g/cm3=1.67g/cm3。

 名校课堂系列答案
名校课堂系列答案