题目内容
【题目】一定温度下,反应C(s)+H2O(g)![]() CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是( )
CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是( )
①增加C的物质的量 ②保持体积不变,充入N2使体系压强增大 ③将容器的体积缩小一半 ④保持压强不变,充入N2使容器体积变大
A. ①② B. ②③ C. ①④ D. ③④
【答案】A
【解析】①因浓度越大,化学反应速率越快,但是固体量的增减不影响反应速率,所以增加C(s)的量,反应速率不变,平衡不移动,故①选;②保持体积不变,充入氮气,氮气不参与反应,反应体系中的各物质的浓度不变,则反应速率不变,平衡不移动,故②选;③将容器的体积缩小一半,增大压强,平衡逆向移动,故③不选;④保持压强不变,充入氮气,使容器的体积变大,相当减小压强,平衡正向移动,故④不选;故选A。

 名校课堂系列答案
名校课堂系列答案【题目】(13分)用辉铜矿(主要成分为 Cu2S,含少量Fe2O3、SiO2,等杂质)制备难溶于水的碱式碳酸铜的流程如下:
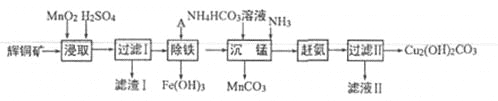
(1)下列措施是为了加快浸取速率,其中无法达到目的的是____(填字母)。
A.延长浸取时间 | B.将辉铜矿粉碎 |
C.充分搅拌 | D.适当增加硫酸浓度 |
(2)滤渣I巾的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的离子方程式:_______。
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是___________。
(4)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A可以是_______(填化学式);“赶氨”时,最适宜的操作方法是________。
(5)“沉锰”(除Mn2+)过程中有关反应的离子方程式为_______。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是___________(填化学式)。
【题目】下列各组物质按如图所示转化关系每一步都能一步实现的是

甲 | 乙 | 丙 | 丁 | |
A | FeCl3 | FeCl2 | Fe2O3 | Fe(OH)3 |
B | Cu | CuO | CuSO4 | CuCl2 |
C | SO2 | H2SO4 | SO3 | H2S |
D | Al(OH)3 | NaAlO2 | Al2O3 | AlCl3 |
A. A B. B C. C D. D

