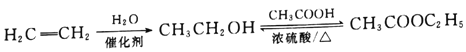题目内容
【题目】[化学一选修3:物质结构与性质]
氮和氧是地球上极为丰富的元素。请回答下列问题:
(1)从原子轨道重叠方式考虑,氮分子中的共价键类型有____________;氮分子比较稳定的原因是_________。
(2)C、N、O的第一电离能由大到小的顺序为_____________(用元素符号表示);NH3易溶于水而CH4难溶于水的原因是____________________________________________。
(3)X+中所有电子恰好充满K、L、M3个电子层。
①X+与N3-形成的晶体结构如图所示。X原子的核外电子运动状态有____种;基态N3-的电子排布式为______;与N3-等距离且最近的X+有______个。
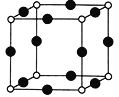
②X2+和Zn2+分别可与NH3形成[X(NH3)4]2+、[Zn(NH3)4]2+,两种配离子中提供孤电子对的原子均为_______(写元素名称)。已知两种配离子都具有对称的空间构型,[Zn(NH3)4]2+中的两个NH3被两个Cl-取代只能得到一种结构的产物,而[X(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种结构不同的产物,则[X(NH3)4]2+的空间构型为_______;[Zn(NH3)4]2+中Zn的杂化类型为_______________。
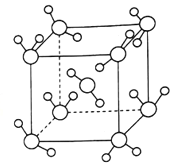
(4)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。已知晶胞参数a=333.7pm,阿伏加德罗常数的值取6.02×1023,则重冰的密度为_______g.cm-3(计算结果精确到0.01)。
【答案】 σ键和π键 氮氮叁键的键能大 N>O>C NH3和H2O分子间形成氢键,CH4为非极性分子,不易溶于水 29 1s22s22p6 6 氮 平面正方形 sp3 1.61
【解析】(1)氮气分子的结构式为NN,其中的共价键类型为一个σ键和两个π键,氮气分子比较稳定的原因就是氮氮叁键的键能大,不易被破坏;
(2)由于同周期元素的第一电离能从左到右一般是逐渐增大的,但N元素最外层的2p上只有3个电子,属于半满状态,比较稳定,所以N元素的第一电离能大于O元素的,因此C、N、O的第一电离能由大到小的顺序为N>O>C;NH3分子中的N元素和水分子中的O元素都具有强的吸引电子能力,它们通过H原子在NH3分子和水分子间形成氢键,因此NH3易溶于水,但CH4中的C元素没有强的吸引电子能力,且CH4为非极性分子,所以不能溶于极性的水中;
(3) ①X+中所有电子恰好充满K、L、M3个电子层,则X原子核外电子数为2+8+18+1 =29,即X是29号元素Cu,因为原子核外没有运动状态完全相同的两个电子存在,所以Cu原子核外电子的运动状态共有29种;基态N3-的电子排布式为1s22s22p6;由晶体结构图可知与N3-等距离且最近的X+有6个,分别在棱的中点,位于N3-的上下、左右、前后六个位置;②NH3分子中的N原子上有孤电子对,所以两种配离子中提供孤电子对的原子为氮元素;已知两种配离子都具有对称的空间构型,[Zn(NH3)4]2+中的两个NH3被两个Cl-取代只能得到一种结构的产物,说明该离子为正四面体结构,其中Zn以sp3杂化提供四个完全等效的共价键,而[Cu(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种结构不同的产物,说明该离子为平面正方形结构,两个氯原子在同一边上或在对角线上,是两种不同的结构;
(4)根据重冰的结构可知,其中含有2个水分子,所以该晶胞的质量为![]() =
=![]() g,其体积为a3=(3.337×10-8cm)3=3.72×10-23cm3,所以其密度为
g,其体积为a3=(3.337×10-8cm)3=3.72×10-23cm3,所以其密度为![]() /3.72×10-23cm3 = 1.61 g/cm3。
/3.72×10-23cm3 = 1.61 g/cm3。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案【题目】描述弱电解质电离情况可以用电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10﹣5 |
HNO2 | 4.6×10﹣4 |
HCN | 5×10﹣10 |
HClO | 3×10﹣8 |
NH3H2O | 1.8×10﹣5 |
表2
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10﹣10 |
BaCO3 | 2.6×10﹣9 |
CaSO4 | 7×10﹣5 |
CaCO3 | 5×10﹣9 |
请回答下列问题:
(1)表1所给的四种酸中,酸性最弱的是_____(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是___(填字母序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈_____(选填“酸性”、“中性”或“碱性”),该溶液中存在的各离子浓度大小关系为_____。
(3)物质的量之比为1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的顺序为_____。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.01molL﹣1,则溶液中CO32-物质的量浓度最少应为_____。