题目内容
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 标准状况下,22.4 L H2O含有的分子数为NA
B. 常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02 NA
C. 通常状况下,NA个CO2分子占有的体积为22.4 L
D. 标准状况下,56 g Fe的体积约为22.4 L
【答案】B
【解析】
A、标况下水不是气态,22.4LH2O含有的分子数N=nNA= ![]() NA,气体摩尔体积22.4L/mol不能代入,选项A错误;B、根据微粒数N=nNA=
NA,气体摩尔体积22.4L/mol不能代入,选项A错误;B、根据微粒数N=nNA=![]() NA=
NA= ![]() ×2NA=0.02NA,选项B正确;C、气体摩尔体积22.4L/ml必须使用于标况下的气体,而不是通常状况下的气体,选项C错误;D、56gFe的物质的量为1mol,标况下Fe是固体,其体积远远小于22.4L,选项D错误。答案选B。
×2NA=0.02NA,选项B正确;C、气体摩尔体积22.4L/ml必须使用于标况下的气体,而不是通常状况下的气体,选项C错误;D、56gFe的物质的量为1mol,标况下Fe是固体,其体积远远小于22.4L,选项D错误。答案选B。

【题目】下列说法不正确的是
A.硫元素的不同单质S2与S8互为同素异形体B.35Cl2和37Cl2互为同位素
C.(CH3)2CHCH3和CH3(CH2)2CH3互为同分异构体D.甲苯和间二甲苯互为同系物
【题目】SO2的防治与利用对于环境保护意义重大。某小组在实验室中对SO2的性质及回收利用等相关问题进行探究。
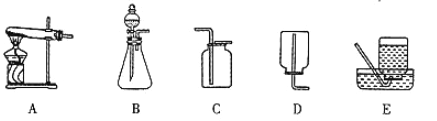
(1)用下图装置制备纯净的SO2,发生装置中反应的化学方程式为________,装置的连接顺序为:a→________(按气流方向,用小写字母表示)

(2)用如图装置探究SO2的性质。限选试剂:NaOH溶液、稀H2SO4、H2O2溶液、FeCl3溶液、 淀粉-KI溶液、新制H2S溶液。

操作步骤 | 实验现象 | 解释原因 |
用注射器将新制H2S溶液注入充满SO2的烧瓶 | 产生乳白色浑浊 | +4价S有_______性 |
用注射器将_______溶液注入充满SO2的烧瓶 | _______ | +4价S有还原性,反应的离子方程式为_______ |
(3)工业上回收利用SO2的一种途径是:
![]()
该小组在实验室探究步骤Ⅱ时,一定条件下向100mL c0mol·L-1的(NH4)2SO3溶液通入空气后,欲测定溶液中(NH4)2SO3的氧化率(α)。
①为该小组设计实验方案(不必描述操作过程的细节,物理量的数值用字母表示):______________________________________________________________________________
②α =________×100%(用实验方案中的物理量表示)。