题目内容
| |||||||||||

(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中. | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色. |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中. | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
置换反应
化合反应
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡.持续电解,在阴极附近的溶液中还可以观察到的现象是
解释此现象的离子方程式是
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来.
①用铝与软锰矿冶炼锰的原理是(用化学方程式来表示)
②MnO2在H2O2分解反应中作催化剂.若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是
(12分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)在不同温度下,反应N2(g)+O2(g) 2NO(g) △H=a kJ·mol-1的平衡常数K如下表:
2NO(g) △H=a kJ·mol-1的平衡常数K如下表:
|
温度/℃ |
1538 |
1760 |
2404 |
|
平衡常数K |
0、86×10-4 |
2、6×10-4 |
64×10-4 |
①该反应的△H 0(填“>”、“=”或“<”)。
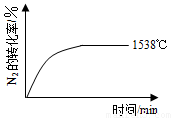
②其他条件相同时,在上述三个温度下分别发生该反应。1538℃时,N2的转化率随时间变化如图所示,
请补充完成1760℃时N2的转化率随时间变化的示意图。
(2)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。相应的热化学方程式如下:
2N2(g)+6H2O(1) =4NH3(g)+3O2(g) △H=+1530kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g) =4NO(g)+6H2O(1) 的反应热△H= 。
(用含a的代数式表示)
(3)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为:N2+3H2 2NH3。则在电解法合成氨的过程中,应将H2不断地通入
极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
2NH3。则在电解法合成氨的过程中,应将H2不断地通入
极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
 (4)合成氨的反应N2(g)+3H2(g)
(4)合成氨的反应N2(g)+3H2(g) 2NH3(g) △H =
-92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
2NH3(g) △H =
-92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
a、升高温度 b、加入催化剂 c、增加H2的浓度
d、增加N2的浓度 e、分离出NH3
(5)在25℃下,将a mol·L-1的氨水与0、01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”), 可推断a 0、01(填大于、等于或小于)。
 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的.难溶金属的氢氧化物在不同pH下的溶解度(s,mol?L-1)见图.
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的.难溶金属的氢氧化物在不同pH下的溶解度(s,mol?L-1)见图.
 如图表示的是25℃时,难溶氢氧化物在不同pH下的溶解度(S/mol?L-1,假定该浓度为饱和溶液中阳离子的浓度).
如图表示的是25℃时,难溶氢氧化物在不同pH下的溶解度(S/mol?L-1,假定该浓度为饱和溶液中阳离子的浓度).