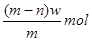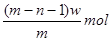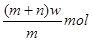题目内容
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期元素。①原子半径:A<C<B<E<D;②原子的最外层电子数:A=D、C=E、A+B=C;③原子的层电子层数:B="C=2A;" ④B元素的最高正价与最低负价数量之差为2,⑤F在地壳中金属含量第二,下列说法正确的是( )
A.因为C的氢化物分子内含氢键所以比E的氢化物稳定
B.过量F与22.4LC单质完全反应,转移4mol电子
C.因为E单质相对于分子质量小于溴单质相对分子质量,所以E单质的熔点比Br2要低
D.A、D形成化合物的水溶液呈碱性
A.因为C的氢化物分子内含氢键所以比E的氢化物稳定
B.过量F与22.4LC单质完全反应,转移4mol电子
C.因为E单质相对于分子质量小于溴单质相对分子质量,所以E单质的熔点比Br2要低
D.A、D形成化合物的水溶液呈碱性
D
试题分析:A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.根据原子的核外电子层数:B=C=2A,可知A为H元素,B、C为第二周期元素,原子的最外层电子数A=D,则D为Na元素,
根据B元素的主要化合价:最高正价+最低负价=2,可知B为N元素,根据原子的最外层电子数:A+B=C,可知C为O元素,原子的最外层电子数:C=E,可知E为S元素,而F为硅。A选项中,H2O与H2S中,由于O的非金属性比S强,所以H2O更稳定,而不是因为氢键的关系。B选项中,硅与1mol O2反应,转移4mol电子,但是22.4LO2没有注明标准状况下。C选项中,在常温下S是固体,而Br2是液体,所以S的熔点比Br2高。D中形成的化合物为NaOH,呈碱性。
点评:本题所考查的元素不难推出,关键在于利用元素周期律判断各元素化合物的性质。本题难度不大,综合性较强。

练习册系列答案
相关题目
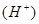 的能力由强到弱的顺序是 (用离子方程式加以说明)。
的能力由强到弱的顺序是 (用离子方程式加以说明)。