题目内容
【题目】“在2支大小相同的试管中各装入2~3 mL约5%的H2O2溶液,再向其中1支试管中滴入1~2滴1 mol/L FeCl3溶液,对比观察现象。”
Ⅰ.体验H2O2分解的实验意义
(1)指出本实验的探究目的:________。
(2)写出H2O2分解反应方程式并标出电子转移的方向和数目:________。
(3)在盛有滴入FeCl3溶液的H2O2溶液中,可观察到溶液中 ________ ;溶液温度升高;溶液由浅黄色变成棕黄色,最后恢复为浅黄色。
Ⅱ.探讨FeCl3催化H2O2分解的机理
(4)Fe3+催化H2O2分解时涉及2步反应:
第1步,Fe3+氧化H2O2:2Fe3++H2O2═2Fe2++O2↑+2H+
第2步,H2O2氧化Fe2+:________(用离子方程式表示)
【答案】 FeCl3对H2O2分解速率的影响 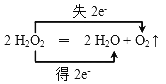 产生大量气泡 2 Fe2+ + H2O2 + 2 H+ ═ 2 Fe3+ + 2H2O
产生大量气泡 2 Fe2+ + H2O2 + 2 H+ ═ 2 Fe3+ + 2H2O
【解析】本题考查表示电子转移的方向和数目以及离子反应方程式的书写,(1)根据在2支大小相同的试管中各装入2~3 mL约5%的H2O2溶液,再向其中1支试管中滴入1~2滴1 mol·L-1 FeCl3溶液,对比观察现象,因此本实验的目的是探究FeCl3对H2O2分解速率的影响;(2)过氧化氢分解的反应方程式为2H2O2=H2O+O2↑,H2O2既是氧化剂又是还原剂,生成1molO2,转移电子1×2mol=2mol,因此电子转移的数目和方向是: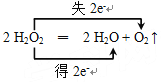 ;(3)FeCl3作催化剂,加快H2O2的分解,溶液中出现大量气泡;(4)利用H2O2的氧化性,把Fe2+氧化成Fe3+,离子反应式为H2O2+2Fe2++2H+=2H2O+2Fe3+。
;(3)FeCl3作催化剂,加快H2O2的分解,溶液中出现大量气泡;(4)利用H2O2的氧化性,把Fe2+氧化成Fe3+,离子反应式为H2O2+2Fe2++2H+=2H2O+2Fe3+。

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目