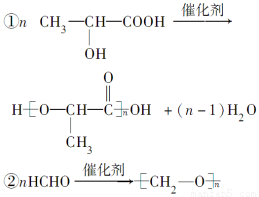
题目内容
某化学学习小组在实验室中探究铁钉与热浓硫酸的反应。其探究流程如图所示:
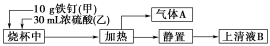
(1)从实验安全的角度考虑,应先向烧杯中加入______(填“甲”或“乙”)。
(2)根据加入的反应物的量,实验需要选取的烧杯的规格为________(填字母序号)。
a.50 mL b.100 mL c.500 mL d.1 000 mL
(3)上述流程图中从“静置”后的混合物中得到上清液B不能采用过滤的操作方法,其原因是__________________________________。
由于铁钉生锈,上清液B中可能既含Fe3+,又含Fe2+,要检验上清液B中有无Fe2+,应加入的试剂是________(填字母序号)。
a.KSCN溶液和氯水
b.铁粉和KSCN溶液
c.NaOH溶液
d.酸性KMnO4溶液
(4)气体A的主要成分是SO2,还可能含有H2和CO2。流程图中“加热”时可能生成CO2的原因是________________(用化学方程式表示)。
利用下列仪器可以同时检验气体A中是否含有H2和CO2(其中的夹持仪器、橡胶管和加热装置已经略去),则仪器的连接顺序是________(填仪器的字母代号),装置A的作用是____________________________,装置B中试剂X的化学式是________。
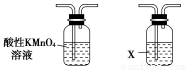
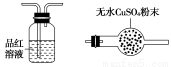
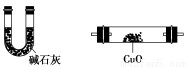
A B C D E F
(1)甲 (2)b
(3)浓硫酸会使滤纸炭化,从而使过滤失败 d
(4)C+2H2SO4(浓) 2SO2↑+CO2↑+2H2O
2SO2↑+CO2↑+2H2O
A—C—B—E—F—D(或A—C—B—E—F—D—E,) 除去气体A中的SO2 Ca(OH)2或Ba(OH)2
【解析】(1)倾斜烧杯,加入铁钉后,沿烧杯内壁缓缓注入浓硫酸。如果先加入浓硫酸,再加铁钉,则容易溅起浓硫酸伤人。(2)浓硫酸为30 mL,已经超过规格为50 mL烧杯容量的1/3,加热时,浓硫酸容易溅出,而500 mL和1 000 mL烧杯容量较大,浓硫酸不能完全没及加入的铁钉,故应选取100 mL烧杯。(3)因为反应后的溶液仍为浓度较高的硫酸,用滤纸过滤,会导致滤纸炭化,从而使过滤失败;检验是否含有Fe2+,可利用其还原性,即加入酸性高锰酸钾溶液,观察溶液的紫色是否褪去。若选择a,无论是否含有Fe2+,溶液都会变为红色,因为溶液中已含有Fe3+;若选择b,则只能检验是
否含有Fe3+,先加入KSCN溶液,溶液变为红色,再加入铁粉,红色褪去;若选择c,即使含有Fe2+,生成的Fe(OH)3沉淀颜色较深,会掩盖Fe(OH)2沉淀的颜色,并且生成的Fe(OH)2沉淀也会迅速转化为红棕色的Fe(OH)3沉淀。(4)铁钉为碳和铁的合金,还可能发生C和浓硫酸的反应。检验CO2利用澄清石灰水或Ba(OH)2溶液,检验H2利用CuO和无水CuSO4粉末,由于SO2会对CO2的检验造成干扰,因此检验前要先除去SO2。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案单质铜及其化合物一般都具有特殊的颜色,如
Cu | Cu2O | CuO | Cu(OH)2 | CuSO4·5H2O |
红色(或紫红色) | 红色(或砖红色) | 黑色 | 蓝色 | 蓝色 |
某学校学习小组甲为检测实验室用H2还原CuO所得红色固体中是否含有Cu2O,进行了认真的研究。
Ⅰ.查阅资料得出下列信息:
①Cu2O属于碱性氧化物;
②高温灼烧CuO生成Cu2O;
③Cu2O在酸性条件下能发生反应:Cu2O+2H+=Cu+Cu2++H2O。
Ⅱ.设计实验方案:
方案1:取该红色固体溶于足量的稀硝酸中,观察溶液颜色变化。
方案2:取该红色固体溶于足量的稀硫酸中,观察溶液是否呈蓝色。
方案3:称得干燥坩埚的质量为a g,取红色固体置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,称得最后总质量为c g。
(1)写出Cu2O与稀硝酸反应的化学方程式:_______________________。
(2)请你评价方案1和方案2的合理性,并简述理由:
方案1:_______________________。
方案2:_______________________。
(3)方案3中,若确认红色固体中含有Cu2O,则a、b、c的关系为________,在该实验方案中最少应进行________次称量。
Ⅲ.学习小组乙设计了新的探究方案,拟根据干燥管中无水硫酸铜是否变蓝判断红色固体中是否含有Cu2O,装置如图所示。

(4)该探究方案中检验气体发生装置气密性的方法为________(说明操作方法、现象和结论)。
(5)为确保探究的科学、合理和安全,你认为实验中还应采取的措施有____(填序号)。
A.在氢气发生装置与硬质玻璃管之间增加一个干燥装置
B.加热前先排尽装置中的空气
C.在盛有无水硫酸铜的干燥管后再连接一个装有碱石灰的干燥管
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)??2Fe(s)+3CO2(g)
ΔH=a kJ·mol-1。
(1)已知:①Fe2O3(s)+3C(s,石墨)=2Fe(s)+3CO(g)
ΔH1=+489.0 kJ·mol-1;
②C(s,石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1。则a=________。
(2)冶炼铁反应的平衡常数表达式K=________,温度升高后,K值________(填“增大”、“不变”或“减小”)。
(3)在T ℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3 | CO | Fe | CO2 |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为________。
②下列说法正确的是________(填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3的量,可以提高CO的转化率
c.甲容器中CO的平衡转化率大于乙的平衡转化率
d.甲、乙容器中,CO的平衡浓度之比为2∶3
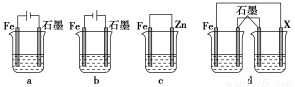
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a、b、c装置中能保护铁的是________(填字母)。
②若用d装置保护铁,X极的电极材料应是________(填名称)。
(5)25 ℃时有关物质的溶度积如下:Ksp[Mg(OH)2]=5.61×10-12,Ksp[Fe(OH)3]=2.64×10-39。25 ℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+)∶c(Fe3+)=________。