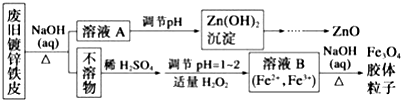
题目内容
11.下列说法中正确的是( )| A. | H3PO4的摩尔质量为98 | |
| B. | 阿伏伽德罗常数即为0.012kg12C所含的碳原子数 | |
| C. | 任何气体的摩尔体积均约为22.4L.mol-1 | |
| D. | 一个标准大气压下4℃时,9mL水中所含电子数约为3.01×1024. |
分析 A、摩尔质量的单位为g/mol;
B、阿伏伽德罗常数的单位为mol-1;
C、气体摩尔体积的数值和气体所处的状态有关;
D、一个标准大气压下4℃时,水的密度为1g/mL.
解答 解:A、摩尔质量的单位为g/mol,故磷酸的摩尔质量为98g/mol,故A错误;
B、阿伏伽德罗常数的单位为mol-1,故应为阿伏伽德罗常数的数值为0.012kg12C所含的碳原子数,故B错误;
C、气体摩尔体积的数值和气体所处的状态有关,和气体的种类无关,故22.4L/mol为气体摩尔体积的一个取值,故C错误;
D、一个标准大气压下4℃时,水的密度为1g/mL,故9mL水的质量为9g,物质的量为0.5mol,而1mol水中含10mol电子,故0.5mol水中含5mol电子即3.01×1024个,故D正确.
故选D.
点评 本题考查了摩尔质量的单位、气体摩尔体积的数值等知识,难度不大,掌握好基础知识是关键.

练习册系列答案
相关题目
1.生产液晶显示器过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久,以下判断正确的是( )
| A. | NF3气体密度比空气小 | B. | 过程N(g)+3F(g)→NF3(g)放出热量 | ||
| C. | NF3属于易燃、高能物质 | D. | NF3室温条件下不稳定 |
19.在下列反应中,生成物总能量比反应物总能量要高的是( )
| A. | 氧化钙溶于水 | B. | 酒精完全燃烧 | C. | 食物氧化腐败 | D. | 高温煅烧石灰石 |
6.试管中盛有少量白色固体,可能是铵盐,检验的方法是( )
| A. | 加氢氧化钠溶液,加热,滴入酚酞试剂 | |
| B. | 加氢氧化钠溶液,加热,滴入紫色石蕊试剂 | |
| C. | 加氢氧化钠溶液,加热,将干燥的红色石蕊试纸靠近试管口 | |
| D. | 加氢氧化钠溶液,加热,将湿润的红色石蕊试纸靠近试管口 |
16.下列有关物质分类的描述正确的是( )
| A. | 金属氧化物一定是碱性氧化物 | |
| B. | SO2水溶液能导电,所以 SO2是电解质 | |
| C. | 胶体是纯净物,可以用丁达尔效应鉴别胶体和溶液 | |
| D. | 人们在认识事物时往往需要采用多种分类方法,来弥补单一分类方法的不足 |
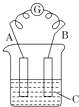 如图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液.
如图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液.