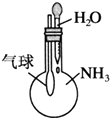
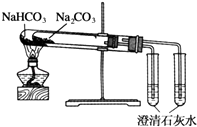
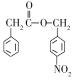
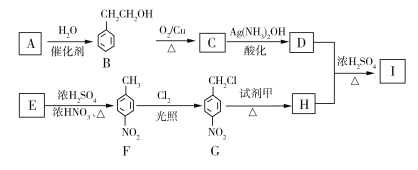
题目内容
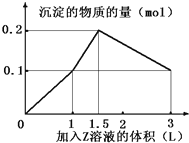
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g) 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g) 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s的平均速率为v (PCl3)=0.0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol·L-1,则反应的△H<0
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前v (正)>v (逆)
D. 相同温度下,起始时向容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
【答案】C
【解析】A、v (PCl3)= ![]() mol·L-1·s-1,A错误;B、原来达平衡n(PCl3)=0.2mol,所以c(PCl3)=0.1 mol·L-1,新平衡中c(PCl3)=0.11 mol·L-1说明升高温度平衡向右移动,正反应吸热△H>0,B错误;C、根据题目数据计算出达平衡时各物质的浓度:c(PCl5)=0.4 mol·L-1,c(PCl3)= c(Cl2)=0.1 mol·L-1,所以平衡常数K=0.025。相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,浓度为c(PCl5)=0.5 mol·L-1,c(PCl3)= c(Cl2)=0.1 mol·L-1,所以Q=0.02<K=0.025,平衡正向进行,v (正)>v (逆),C正确;D、若起始时加入1.0 mol PCl3、1.0 mol Cl2,则和题目初始时加入1.0molPCl5的关系是等效平衡,达平衡时平衡态应该相同,即n(PCl3)=0.2mol,所以PCl3的转化率为80%。D选项改为加入入2.0 mol PCl3、2.0 mol Cl2,是加入1.0 mol PCl3、1.0 mol Cl2的二倍,恒容下投料量翻倍,相当于增大压强,所以转化率增加,应该大于80%,D错误。
mol·L-1·s-1,A错误;B、原来达平衡n(PCl3)=0.2mol,所以c(PCl3)=0.1 mol·L-1,新平衡中c(PCl3)=0.11 mol·L-1说明升高温度平衡向右移动,正反应吸热△H>0,B错误;C、根据题目数据计算出达平衡时各物质的浓度:c(PCl5)=0.4 mol·L-1,c(PCl3)= c(Cl2)=0.1 mol·L-1,所以平衡常数K=0.025。相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,浓度为c(PCl5)=0.5 mol·L-1,c(PCl3)= c(Cl2)=0.1 mol·L-1,所以Q=0.02<K=0.025,平衡正向进行,v (正)>v (逆),C正确;D、若起始时加入1.0 mol PCl3、1.0 mol Cl2,则和题目初始时加入1.0molPCl5的关系是等效平衡,达平衡时平衡态应该相同,即n(PCl3)=0.2mol,所以PCl3的转化率为80%。D选项改为加入入2.0 mol PCl3、2.0 mol Cl2,是加入1.0 mol PCl3、1.0 mol Cl2的二倍,恒容下投料量翻倍,相当于增大压强,所以转化率增加,应该大于80%,D错误。

【题目】用0.001mol/L的酸性高锰酸钾溶液滴定未知浓度的草酸(H2C2O4)溶液,回答下列 问题:
(1)酸性高锰酸钾溶液应该装在下图__________滴定管中。
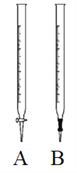
(2)请写出该反应的离子方程式:____________________。
(3)用0.001mol/L的酸性高锰酸钾溶液滴定草酸溶液,滴定终点的判断依据是:_________________。
(4)己知滴定V1ml待测液消耗标准液实验数据如下表
实验次数 | 始读数(ml) | 末读数(ml) | 消耗体积 |
1 | 0.10 | 19.20 | 19.10 |
2 | 1.85 | 20.75 | 18.90 |
3 | 0.00 | 24.06 | 24.06 |
则待测液的浓度为:_______________
(5)滴定结束时,俯视刻度线读取高锰酸钾溶液的体积,会导致测定结果_________(填“偏大”“偏小”或“不影响”)
(6)己知NaHC2O4溶液中草酸氢根离子的电离大于水解,则溶液中各离子的浓度按由大到小的顺序排列的是:_________________________。