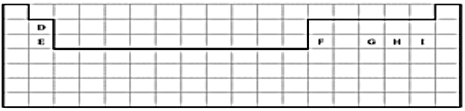
��Ŀ����
����Ŀ���±��е�ʵ�߱�ʾԪ�����ڱ��IJ��ֱ߽硣

��1�������ϱ�����ʵ�߲���Ԫ�����ڱ����ϱ߽硣_____________
��2��ij����Ԫ��ԭ�ӵĺ�������Ų�Ϊ�� ����Ԫ����Ԫ�����ڱ��е�λ��Ϊ_______________��
����Ԫ����Ԫ�����ڱ��е�λ��Ϊ_______________��
��3��Ԫ��I�ķǽ�����________(�ǿ�ڡ������ڡ�)Ԫ��H����ԭ�ӽṹ�Ĺ۵����ԭ��ͬ����Ԫ������ԭ�������ĵ�����______________________���ǽ�������ǿ�����ʵ��֤��Ԫ��E�Ľ�����ǿ��Ԫ��F��_______________________________________��
��4���������ڱ��жԽ���λ��(���Ϸ������·�) ��Ԫ�أ������ʾ��������ԣ���Ϊ���Խ��߹���Ԫ��D��F�ĵ��ʼ��仯�����������ƣ���D��DO��D(OH)2��NaOH��Һ���ܷ�Ӧ����Na2DO2�����ʡ��ش��������⡣
��д��F�ĵ���������������Һ��Ӧ�����ӷ���ʽ___________________________��
�ڼ���Ԫ��D��E��������������Լ���_________________��
��5��Ԫ��G��һ�ֺ����ữѧʽΪ��H3GO3����ṹʽ�ɱ�ʾΪ�� ����д���������������������Һ��Ӧ�Ļ�ѧ����ʽ_________________________________��
����д���������������������Һ��Ӧ�Ļ�ѧ����ʽ_________________________________��
��Ϣ������ԭ�ӽ�ϳɵ�һ��ԭ���š���OH�����ǻ������������ǻ��ⷽ�ɵ����H+��
���𰸡� 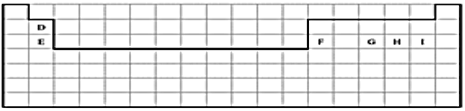 �������ڵڢ�A�� ǿ�� ԭ�Ӱ뾶�ݼ����õ���������ǿ ����ĥ����þ���������ֱ�Ͷ��ʢ����ͬ������Թ��У�þ����Ӧ������ 2Al+2H2O+ 2OH-=2AlO2-+3H2�� NaOH��Һ H3PO3+2NaOH=Na2HPO3+2H2O
�������ڵڢ�A�� ǿ�� ԭ�Ӱ뾶�ݼ����õ���������ǿ ����ĥ����þ���������ֱ�Ͷ��ʢ����ͬ������Թ��У�þ����Ӧ������ 2Al+2H2O+ 2OH-=2AlO2-+3H2�� NaOH��Һ H3PO3+2NaOH=Na2HPO3+2H2O
����������1��ʵ�߲���Ԫ�����ڱ����ϱ߽�Ϊ��
��2����2��ij����Ԫ��ԭ�ӵĺ�������Ų�Ϊ�� �����Ӳ�Ϊ4�㣬���������������������������ӣ��ʸ�Ԫ���ڵ�VIA�壬��Ԫ����Ԫ�����ڱ��е�λ��Ϊ�������ڵڢ�A�壻
�����Ӳ�Ϊ4�㣬���������������������������ӣ��ʸ�Ԫ���ڵ�VIA�壬��Ԫ����Ԫ�����ڱ��е�λ��Ϊ�������ڵڢ�A�壻
��3��Ԫ��IΪCl��Ԫ��HΪS��Cl�ķǽ�����ǿ��Ԫ��S����Ϊͬ����Ԫ������ԭ�������ĵ�����ԭ�Ӱ뾶�ݼ����õ���������ǿ���ǽ�������ǿ��Ҫ֤��Ԫ��Mg�Ľ�����ǿ��Ԫ��Al�����Խ�����ĥ����þ���������ֱ�Ͷ��ʢ����ͬ������Թ��У��Ƚ����ᷴӦ�ľ��ҳ̶ȣ�
��4����FԪ����Al��Al������������Һ��Ӧ�����ӷ���ʽΪ��2Al+2H2O+ 2OH-=2AlO2-+3H2����
��D��Be����Al�ǶԽ���λ�ã���Be��������Al���ƣ�Ԫ��Be����������������ԣ�Mg������������û�����ԣ��ʼ���Ԫ��Be��Mg��������������Լ���NaOH��Һ��
��5��H3PO3��������ṹʽ��H3PO3�Ƕ�Ԫ�ᣬ�������������������Һ��Ӧ�Ļ�ѧ����ʽΪH3PO3+2NaOH=Na2HPO3+2H2O��

����Ŀ����ȥ���������е�����,�����Լ��ͷ�����ȷ���� (����)
ѡ�� | ���� | ���� | �����������Լ��ͷ��� |
A | KCl���� | I2 | ����,���� |
B | KNO3 | K2SO4 | BaCl2��Һ,���� |
C | Cu | CuO | ϡ����,���� |
D | CaCO3 | Ca(OH)2 | ����,���� |
A. A B. B C. C D. D


