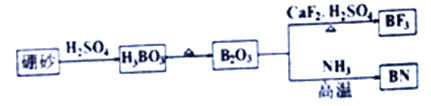
题目内容
【题目】19世纪中叶,门捷列夫的突出贡献是( )
A.提出原子学说B.发现氧气
C.提出分子学说D.发现元素周期律
【答案】D
【解析】
1869年,俄国化学家门捷列夫发现元素周期律,并编制出元素周期表,使化学学习和研究变得有规律可循,预测出新元素的性质成为可能,答案选D。

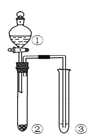
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
【题目】某化学兴趣小组做以下属于对SO2的性质进行研究。请回答下列问题:
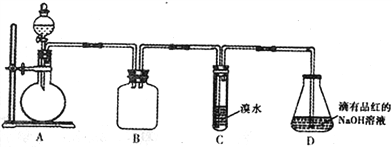
(1)装置B的作用是_______________________。
(2)装置C的目的是检验SO2的_____性。装置D中NaOH全部转化为NaHSO3的标志是_______________。
(3)请设计简单实验证明:室温下,NaHSO3溶液中HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小关系_______________________________。
(4)向装置D所得NaHSO3溶液中加入NaClO溶液时,反应有下列三种可能的情况:
Ⅰ.HSO3-与ClO-恰好反应 Ⅱ. NaClO不足 Ⅲ. NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HClO)
实验序号 | 实验操作 | 现象 | 结论 |
① | 加入几小块CaCO3固体 | 有气泡产生 | Ⅰ或Ⅱ |
② | 滴加少量淀粉KI溶液,振荡 | __________ | Ⅲ |
③ | 滴加少量溴水,振荡 | _________ | Ⅱ |
④ | 滴加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | ______ |
(5)测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2 +2H2O==H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为_________g·L-1。
②在上述实验过程中,若有部分HI 被空气氧化,则测得结果________(填“偏高”、偏低”或“不变”)。