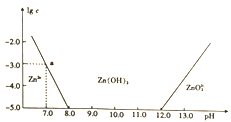
题目内容
【题目】某绿色农药结构简式如图,回答下列问题。

(1)基态硒原子价电子排布式为__________,该农药组成元素中,第一电离能较大的前三种元素是________(按由大到小顾序排列)。
(2)分子中编号为①的碳原子和与其成键的另外几个原子构成的空间结构为_________;CSe2首次是由H2Se 和CCl4 反应制取的,试比较上述三种分子的键角_____________(按由大到小顺序排列)。
(3)H2SeO3 分子的中心原子杂化类型是____________,试比较H2SeO3、H2SeO4 和H2SO4三种酸的酸性强弱(按由强到弱顺序排列)_______________。
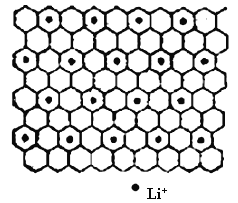
(4)石墨是碳元素的一种同素异形体,石墨晶体可看作ABABA...堆积方式。碱金属离子可填充在石墨层问形成石墨夹层化合物,同时堆积方式从ABABAB...变为AAAA...。下图为石墨夹层化合物W 的投影图,试写出W 的学式_____,微粒之间存在的化学键有______。
【答案】4s24p4F>N>O四面体形Cse2> CCl4> H2Sesp3H2SO4> H2SeO4> H2SeO3C8Li离子键和共价键
【解析】
(1)硒为34号元素,基态硒原子价电子排布式为4s24p4,由元素的非金属性的强弱可知电负性:F>O>N,由于氮原子最外层电子处于半充满的较稳定状态,使得氮的第一电离能大于氧,所以第一电离能:F>N>O故答案为:4s24p4、F>N>O;(2)编号为①的碳原子全部以单键的形式与其它原子相结合,故空间结构为四面体形,CSe2分子为直线形分子,H2Se为V形分子,CCl4为正四面体形分子,故三种分子的键角由大到小为:Cse2> CCl4> H2Se;故答案为:四面体形、Cse2> CCl4> H2Se;(3)H2SeO3 分子的中心原子的价层电子对数为(6+2+3×0)÷2=4,则H2SeO3 分子的中心原子杂化类型是sp3;H2SeO3、H2SeO4和H2SO4三种酸的非羟基氧原子数分别是1、2、2,非金属性:S>Se,所以酸性:H2SO4>H2SeO4>H2SeO3,故答案为:sp3、 H2SO4> H2SeO4> H2SeO3;(4)平均每4个六元环含有1个Li+,每个六元环平均含有2个碳原子,所以W的化学式为C8Li,微粒之间存在的化学键有金属原子与非金属原子之间形成的离子键和非金属原子之间的共价键,故答案为:C8Li 、离子键和共价键。

 阅读快车系列答案
阅读快车系列答案【题目】下表列出了①~⑥六种元素在周期表中的位置:
族 周期 | ⅠA | 0 | ||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ||||
请按要求回答下列问题。
⑴元素②的单质电子式是_________。
⑵元素⑤与⑥气态氢化物的热稳定性比较(填化学式):_________。
⑶这六种元素中,位于第三周期且原子半径最小元素的原子结构示意图_____。
⑷这六种元素中,能与氧结合,生成物可做耐火材料的是(填元素符号)_________。
⑸在盛有水的小烧杯中加入元素③的单质,发生反应的离子方程式为_________; 向上述反应后的溶液中再通入元素⑥的单质,发生反应的化学方程式为_____