题目内容
4. 在0.24L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题.
在0.24L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题.(1)该混合液中,NaCl的物质的量为0.24mol,含溶质MgCl2的质量为11.4g.
(2)该混合液中CaCl2的物质的量为0.12mol,将该混合液加水稀释至体积为1200mL,稀释后溶液中Ca2+的物质的量浓度为0.1mol•L-1.
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀0.72mol.
分析 (1)由图可知,c(Na+)=1.0mol/L,、c(Mg2+)=0.5mol/L,结合n=cV、m=nM计算;
(2)结合电荷守恒计算c(Ca2+),结合n=cV、c=$\frac{n}{V}$计算;
(3)加入足量硝酸酸化的硝酸银溶液,氯离子转化为AgCl沉淀.
解答 解:(1)由图可知,c(Na+)=1.0mol/L,该混合液中,NaCl的物质的量为0.24L×1.0mol/L=0.24mol;c(Mg2+)=0.5mol/L,含溶质MgCl2的质量为0.24L×0.5mol/L×95g/mol=9.5g,
故答案为:0.24;11.4;
(2)由电荷守恒可知2c(Ca2+)+c(Na+)+2c(Mg2+)=c(Cl-),解得:c(Ca2+)=$\frac{3.0-1.0-0.5×2}{1L}$=0.5mol/L,混合液中CaCl2的物质的量为:0.24L×0.5mol/L=0.12mol,该混合液加水稀释至体积为1200mL,稀释过程中溶质的物质的量不变,则稀释后溶液中Ca2+的物质的量浓度为:c=$\frac{0.12mol}{0.12L}$=0.1mol/L,
故答案为:0.12;0.1;
(3)加入足量硝酸酸化的硝酸银溶液,氯离子转化为AgCl沉淀,n(AgCl)=n(Cl-)=3mol/L×0.24L=0.72mol,
故答案为:0.72.
点评 本题考查了物质的量、物质的量浓度的计算,题目浓度中等,明确稀释过程中溶质的物质的量不变及电荷守恒的应用方法为解答关键,注意熟练掌握物质的量浓度概念及计算方法.

练习册系列答案
相关题目
14.已知水的电离方程式:H2O═H++OH-.下列叙述中,正确的是( )
| A. | 升高温度,KW增大,pH不变仍为中性 | |
| B. | 向水中加入少量硫酸,c(H+)增大 | |
| C. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| D. | 一定温度下,向水中加入少量固体CH3COONa,平衡向正反应方向移动,Kw增大 |
15.下列叙述中,不 正确的是( )
| A. | 金刚石和石墨均为碳元素组成的单质 | |
| B. | CO2:弱电解质 | |
| C. | 蓝矾(CuSO4•5H2O)和干冰属于化合物,铁矿石属于混合物 | |
| D. | 醋酸:一元弱酸 |
12.下列有关金属腐蚀与防护的说法正确的是( )
| A. | 金属腐蚀包括化学腐蚀和电化学腐蚀两种,其中化学腐蚀更为普遍 | |
| B. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| C. | 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| D. | 可将地下输油钢管与外加直接电源的正极相连以保护它不受腐蚀 |
19.下列物质的熔点或液化温度由高到低顺序正确的是( )
| A. | HBr>HCl>HF | B. | 锂>钾>钠 | ||
| C. | NaF>NaCl>NaBr | D. | 金刚石>晶体硅>碳化硅 |
16.下列装置及操作均正确的是( )
| A. | 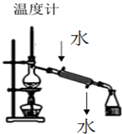 装置用于分离两种沸点相差较大的液体互溶混合物 | |
| B. |  装置称量氢氧化钠固体 | |
| C. |  装置配制一定物质的量浓度的稀硫酸 | |
| D. |  装置检查容量瓶是否漏水 |