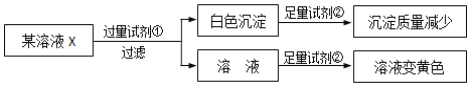
题目内容
【题目】下列反应中水既不是氧化剂,又不是还原剂的氧化还原反应是( )
A.SO3+H2O=H2SO4
B.2Na2O2+2H2O=4NaOH+O2↑
C.2F2+2H2O=4HF+O2
D.NaH+H2O=NaOH+H2↑
【答案】B
【解析】解:A.反应中元素的化合价不变,不属于氧化还原反应,故A不选;B.Na2O2中,O元素的化合价既升高又降低,属于氧化还原反应,但水中H、O元素的化合价不变,水既不是氧化剂又不是还原剂,故B选;
C.水中O元素的化合价升高,属于氧化还原反应,且水为还原剂,故C不选;
D.水中H元素的化合价降低,属于氧化还原反应,且水为氧化剂,故D不选;
故选:B.

【题目】某小组同学进行实验研究FeCl3溶液和Na2S溶液的反应。
【实验一】

已知:FeS、Fe2S3均为黑色固体,均能溶于盐酸。H2S气体有臭鸡蛋气味。
同学们对黑色沉淀的成分提出两种假设:
ⅰ.Fe3+与S2反应直接生成沉淀Fe2S3。ⅱ.Fe3+被S2还原,生成沉淀FeS和S。
甲同学进行如下实验:
操作 | 现象 |
取少量FeS固体,加入稀盐酸 | 固体溶解,有臭鸡蛋气味气体生成 |
取少量Fe2S3固体,加入稀盐酸 | 固体溶解,出现淡黄色浑浊,有臭鸡蛋气味气体生成 |
根据上述实验现象和资料,甲得出结论:黑色沉淀是Fe2S3。
(1)0.1 mol·L 1 Na2S溶液的pH为12.5。用离子方程式表示其显碱性的原因:_______。
(2)乙认为甲的结论不严谨,理由是________。
(3)进一步研究证实,黑色沉淀的主要成分是Fe2S3。Na2S溶液呈碱性,FeCl3溶液与其反应不生成Fe(OH)3而生成Fe2S3的可能原因是________。
【实验二】
步骤 | 操作 | 现象 |
I |
| 开始时,局部产生少量的黑色沉淀,振荡,黑色沉淀立即消失,同时溶液中产生淡黄色浑浊和臭鸡蛋气味的气体 |
II | 继续滴加Na2S溶液 | 一段时间后,产生大量的黑色沉淀,振荡,沉淀不消失 |
(4)进一步实验证实,步骤 I 中局部产生少量的黑色沉淀是Fe2S3,黑色沉淀溶解的主要原因不是Fe2S3与溶液中Fe3+发生氧化还原反应。步骤 I 中黑色沉淀溶解的反应的离子方程式是________。
(5)根据以上研究,FeCl3溶液和Na2S溶液反应的产物与________相关。
【题目】已知一定条件下断裂或形成某些化学键的能量关系如下表:
断裂或形成的化学键 | 能量数据 |
断裂1 mol H2分子中的化学键 | 吸收能量436 kJ |
断裂1 mol Cl2分子中的化学键 | 吸收能量243 kJ |
形成1 mol HCl分子中的化学键 | 释放能量431 kJ |
对于反应:H2(g)+Cl2(g)===2HCl(g),下列说法正确的是
A. 该反应的反应热ΔH>0
B. 生成1 mol HCl时反应放热431 kJ
C. 氢气分子中的化学键比氯气分子中的化学键更牢固
D. 相同条件下,氢气分子具有的能量高于氯气分子具有的能量