��Ŀ����
����Ŀ���ڳ�ʼ�¶�Ϊ500�桢�ݻ��㶨Ϊ10L�������ܱ������У���ͼ���Ϸ�����Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)��H=-25kJ/mol����֪�Ҵﵽƽ��ʱ�����ѹǿΪ��ʼʱ��0.55�����ҡ����г�ʼ��Ӧ����ͬ��ƽ����Ӧ����ֵ����������ȡ����з�����ȷ���ǣ� ��
CH3OH(g)+H2O(g)��H=-25kJ/mol����֪�Ҵﵽƽ��ʱ�����ѹǿΪ��ʼʱ��0.55�����ҡ����г�ʼ��Ӧ����ͬ��ƽ����Ӧ����ֵ����������ȡ����з�����ȷ���ǣ� ��
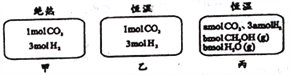
A. �տ�ʼ��Ӧʱ���ʣ���>�� B. ƽ���Ӧ���ȣ���>��
C. 500���¸÷�Ӧƽ�ⳣ����K=3��102 D. ��a��0����0.9��b��l
���𰸡�D
��������A���տ�ʼ��Ӧʱ�����и���ֵ�Ũ����ȣ����Կ�ʼʱ��Ӧ������ȣ�A����B������һ��������ϵ�����ŷ�Ӧ�Ľ��У��ų�������ʹ����ϵ���¶����ߣ�����ƽ�������ƶ����������Ǻ�����ϵ�����Լ��൱�����ҵĻ����������ƶ��ˣ���ƽ���Ӧ���ȣ��ף��ң�B����C���������̼��ת������xmol�����ݷ���ʽ��֪
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
��ʼ����mol��1 3 0 0
�仯����mol��x 3x x x
ƽ������mol��1-x 3-3x x x
��(1x+33x+x+x)/4=0.55����ã�x=0.9������ƽ�ⳣ��K=![]() ��C����D���ҡ����г�ʼ��Ӧ����ͬ��ƽ����Ӧ����ֵ����������ȣ���ʱ���߽�����ƽ���ǵ�Ч�ģ�����C�ļ��㣬ƽ��ʱ�״������ʵ�����0.9mol������0.9��b��l��D��ȷ����ѡD��
��C����D���ҡ����г�ʼ��Ӧ����ͬ��ƽ����Ӧ����ֵ����������ȣ���ʱ���߽�����ƽ���ǵ�Ч�ģ�����C�ļ��㣬ƽ��ʱ�״������ʵ�����0.9mol������0.9��b��l��D��ȷ����ѡD��

����Ŀ��������Ҫ�İ뵼����ϣ��������ִ����ӹ�ҵ�Ļ�������ش��������⣺
��1����̬Siԭ���У�����ռ�ݵ�����ܲ����Ϊ �� ���ܲ���е�ԭ�ӹ����Ϊ��������Ϊ ��
��2������Ҫ�Թ����Ρ��Ȼ��������ʽ�����ڵؿ��У�
��3�����ʹ��������ʯ�ṹ���Ƶľ��壬����ԭ����ԭ��֮�������ϣ��侧���й���8��ԭ�ӣ�����������λ�ù�����ԭ�ӣ�
��4�����ʹ��ͨ�����飨SiH4���ֽⷴӦ���Ʊ�����ҵ�ϲ���Mg2Si��NH4Cl��Һ�������з�Ӧ�Ƶ�SiH4 �� �÷�Ӧ�Ļ�ѧ����ʽΪ ��
��5��̼����йػ�ѧ������������ʾ����Ҫ�����ͽ��������й���ʵ��
��ѧ�� | C��C | C��H | C��O | Si��Si | Si��H | Si��O |
����/��kJmol��1 | 356 | 413 | 336 | 226 | 318 | 452 |
�ٹ���̼ͬ�壬Ҳ��ϵ���⻯�������������������϶�Զ���������࣬ԭ���� ��
��SiH4���ȶ���С��CH4 �� �������������ԭ���� ��
��6���ڹ������У�SiO4��4�����壨��ͼ1��ͨ�����ö��������ӿ��γɵ�״����״����״���Ǽ���״�Ĵ���ṹ��ʽ��ͼ��2��Ϊһ�����������ṹ�Ķ�����������Siԭ�ӵ��ӻ���ʽΪ �� Si��O��ԭ����֮��Ϊ �� ��ѧʽΪ �� 