题目内容
【题目】已知非金属单质硫(S)是淡黄色固体扮末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验。请回答下列问题:
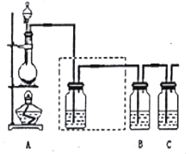
(1)装置A的分液漏斗中盛装的试剂是_______,烧瓶中发生反应的离子方程式为_____________________。氧化剂与还原剂的物质的量之比为_________________。
(2)虚线框内的实验装置图中所加试剂为_______,说明装置的作用_________。
(3)装置B中盛放的试剂是_______(选填下列所给试剂的代码)。实验现象为________,离子方程式是___________,该反应属于四种基本反应类型中的_______反应。
A. Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气。写出该反应的离子方程式_______________。
【答案】 浓盐酸 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 1:2 饱和食盐水 除氯化氢 A 有黄色沉淀 Cl2+S2- = 2Cl-+S 置换 【答题空10】Cl2+2OH- = Cl-+ClO-+H2O
Mn2++Cl2↑+2H2O 1:2 饱和食盐水 除氯化氢 A 有黄色沉淀 Cl2+S2- = 2Cl-+S 置换 【答题空10】Cl2+2OH- = Cl-+ClO-+H2O
【解析】(1)为验证氯元素的非金属性比硫元素的非金属性强,需要用氯气置换出硫,则必须用装置A制备氯气,实验室通常用浓盐酸与二氧化锰反应制取氯气,则A装置中A的分液漏斗中盛装的试剂是浓盐酸,烧瓶中加入的试剂是MnO2,烧瓶中发生反应的离子方程式为:MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O;氧化剂为二氧化锰,还原剂为盐酸,物质的量之比为:1:2;(2)虚线框内的实验装置图中所加试剂为饱和食盐水,用于除去氯气中的氯化氢气体;(3)要在B中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液,发生的是置换反应,实验现象为有黄色沉淀产生,离子反应方程式为:Cl2+S2- = 2Cl-+S;(4)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气。反应生成氯化钠和次氯酸钠,其离子方程式为:Cl2+2OH- = Cl-+ClO-+H2O。
Mn2++Cl2↑+2H2O;氧化剂为二氧化锰,还原剂为盐酸,物质的量之比为:1:2;(2)虚线框内的实验装置图中所加试剂为饱和食盐水,用于除去氯气中的氯化氢气体;(3)要在B中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液,发生的是置换反应,实验现象为有黄色沉淀产生,离子反应方程式为:Cl2+S2- = 2Cl-+S;(4)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气。反应生成氯化钠和次氯酸钠,其离子方程式为:Cl2+2OH- = Cl-+ClO-+H2O。