题目内容
【题目】有X、Y、Z、W四种短周期元素,原子序数依次增大。X元素原子的半径最小。Z、W在周期表中处于邻位置,它们的单质在通常状况下均为无色气体。Y原子的最外层电子数是次外层子数的2倍。请回答:
(1)Z2的电子式为___________,YW2的结构式为____________。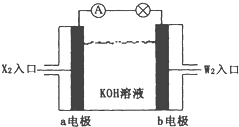
(2)将X2、W2按上图所示通入某燃料电池中,其中,b电极的电极反应式为__________________。若有16gW2参加反应,转移的电子数是____________。
(3)由X、Y、Z、W四种元素组成的无机酸酸式盐_______(化学式),与足量的NaOH溶液在加热条件下反应的离子方程式为________________________________________。
【答案】 ![]()
![]() O2+2H2O+4e-=4OH- 2NA NH4HCO3(化学式) NH4++HCO3-+2OH-=NH3↑+CO32-+2H2O
O2+2H2O+4e-=4OH- 2NA NH4HCO3(化学式) NH4++HCO3-+2OH-=NH3↑+CO32-+2H2O
【解析】X元素原子的半径最小,则X为H元素,Z、W在周期表中处于相邻位置,它们的单质在通常状况下均为无色气体,只有Z为N元素,W为O元素符合,Y原子的最外层电子数是次外层电子数的2倍,则Y为C元素,
(1)根据分子的组成书写电子式和判断分子结构式;
(2)氢氧燃料电池中,通氢气一端为负极,通氧气一端为正极,正极上氧气得到电子,结合电极方程式计算;
(3)X、Y、Z、W四种元素组成的酸式盐为NH4HCO3,与NaOH加热反应生成氨气、水和碳酸钠。
详解: (1)Z为N元素,单质为N2,为非金属单质,N原子之间有3个共用电子对,电子式为![]() , CO2为直线形分子,结构式为O=C=O,
, CO2为直线形分子,结构式为O=C=O,
因此,本题正确答案是:![]() ;O=C=O;
;O=C=O;
(2)氢氧燃料电池中,通氢气一端为负极,通氧气一端为正极,所以b为正极,正极上氧气得到电子,电极反应为O2+2H2O+4e-=4OH-,若有16gO2参加反应,n(O2)=![]() =0.5mol,转移的电子数0.5mol×4×NA /mol=2NA ,
=0.5mol,转移的电子数0.5mol×4×NA /mol=2NA ,
因此,本题正确答案是: O2+2H2O+4e-=4OH-;2NA;
(3)X、Y、Z、W四种元素组成的酸式盐为NH4HCO3,与NaOH加热反应生成氨气、水和碳酸钠,离子反应为NH4++HCO3-+2OH-![]() NH3↑+CO32-+2H2O,
NH3↑+CO32-+2H2O,
因此,本题正确答案是: NH4++HCO3-+2OH-![]() NH3↑+CO32-+2H2O。
NH3↑+CO32-+2H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
