��Ŀ����
����֪��Ũ���������������Һ�У���������ɫ���壬����Һ���Ϻ�ɫ��ȥ������һ��������ԭ��Ӧ����ϵ�й���KCl��Cl2��H2SO4��H2O��KMnO4��MnSO4��K2SO4�������ʣ�
��1���÷�Ӧ�У����ϼ����ߵķ�Ӧ������������������
��2��д��һ�����������������ʵ�������ԭ��Ӧ����ʽ������������������������
��3��������Ӧ�У�����������������1 mol�������ڷ�Ӧ�еõ� ������mol���ӡ�
��ij�о���ѧϰС����������װ���Ʊ�Ư�ۣ�������Ư����Ч�ɷֵ����������ⶨ
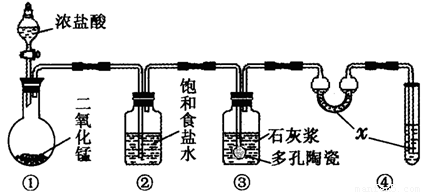
��1��װ�â��е�x�Լ�Ϊ ��
��2��װ�â��з�����Ӧ�Ļ�ѧ����ʽΪ ���÷�Ӧ�Ƿ��ȷ�Ӧ����Ӧ�¶Ƚϸ�ʱ�и���Ӧ�������Ľ���ʵ��װ���Լ��ٸ���Ӧ�����ķ�����
_________________________��
��3���ⶨƯ����Ч�ɷֵ���������
��ȡ1.000 gƯ������ƿ�У���ˮ�ܽ⣬������Һ��pH���Ե���Ϊָʾ������0.1000 mol��L��1 KI��Һ���еζ�����Һ�����ȶ�dz��ɫʱΪ�ζ��յ㡣��Ӧԭ��Ϊ��
3ClO��+ I�� = 3Cl��+ IO3�� IO3�� + 5I�� + 3H2O = 6OH�� + 3I2
ʵ�����������±���ʾ��
|
����� |
1 |
2 |
3 |
|
KI��Һ���/mL |
19.98 |
20.02 |
20.00 |
��Ư������Ч�ɷֵ���������Ϊ �����ζ�������δ�������Һ�ֲ���dz��ɫʱ��ֹͣ�ζ�����ⶨ����� ���ƫ�ߡ�����ƫ�͡�����Ӱ�족��
��1��KCl��1�֣�
��2��2KMnO4+10KCl+8H2SO4=6K2SO4+2MnSO4+5Cl2+8H2O��3�֣�
��3��KMnO4 ��1�֣� 5mol ��2�֣�
��1��NaOH ��1�֣� ��2��2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O��3�֣�
��װ�â۷�����ˮԡ�н���ʵ�飨2�֣� ��3��42.90�� ��2�֣� ƫ�ͣ�2�֣�
��������
������������������֪���������ʵ�������ԭ��ӦΪ2KMnO4+10KCl+8H2SO4=6K2SO4+2MnSO4+5Cl2+8H2O�����ϼ����ߵ�����ΪKCl��������ΪKMnO4 �� 1mol�������õ���5mol ��
����Ϊ�����ж�������x�Լ�ΪNaOH,���ն����������װ�â���ȡƯ�ۣ���ӦΪ2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O��Ϊ�����¶Ƚϸ�ʱ��������Ӧ���ɽ�װ�â۷�����ˮԡ�н���ʵ�飻��3����Ӧ�����ĵ�KI��ƽ�����Ϊ20.00mL�������ʵ���Ϊ0.1000mol/L��0.02L=0.002mol��
�����С���Һ�����ȶ�dz��ɫʱΪ�ζ��յ㡱��ȷ��Ӧ�÷�Ӧ��1�����⣺
�ɹ�ϵʽ3ClO����I��
3 1
n 0.002
n=0.006mol����n��Ca��ClO��2��=0.003mol��m=0.429g��
���㣺������ԭ��Ӧ����ѧʵ�顢�ζ�ʵ�顣

 ��֪��Ũ���������������Һ�У���������ɫ���壬����Һ���Ϻ�ɫ��ȥ������һ��������ԭ��Ӧ����ϵ�й���KCl��Cl2��H2SO4��H2O��KMnO4��MnSO4��K2SO4�������ʣ�
��֪��Ũ���������������Һ�У���������ɫ���壬����Һ���Ϻ�ɫ��ȥ������һ��������ԭ��Ӧ����ϵ�й���KCl��Cl2��H2SO4��H2O��KMnO4��MnSO4��K2SO4�������ʣ�
 SO4��K2SO4�������ʣ�
SO4��K2SO4�������ʣ�