��Ŀ����
����Ŀ��ij��Һ���ܺ���H����K����Mg2����Al3����Fe3����Cl����SO![]() ��CO
��CO![]()
��1��ȡ����Һ20 mL������NaOH��Һ��ֻ������ɫ�������Ҳ����ij����������1.0 mol��L��1NaOH��Һ�����֮��Ĺ�ϵ��ͼ��ʾ��ˮ����һ�����е���������___________�������ʵ���֮����_________�������ų�______�Ĵ��ڡ�
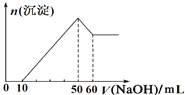
��2����ȡ����Һ20 mL��������BaCl2��Һ���õ�4.66 g����������ij������Ը�������ʵ���Ʋ�Cl���Ƿ���ڣ�___ (����������������)��
��3����ȷ����������______����ͨ��____________����ȷ�����Ƿ���ڡ�
���𰸡� H+�� Al3+ ��Mg2+ 2��2��1 Fe3+��CO32- �� K+ ��ɫ��Ӧ
�������������������1������10 mL 1.0 mol��L��1 NaOH��Һû�г���������˵��ԭ��Һ����H������H�����ʵ�����0.01mol������NaOH��Һ��ֻ������ɫ������˵��û��Fe3������������������������������������٣��Ҳ�����ȫ�ܽ���˵��ԭ��Һ����Mg2����Al3��������10 mL![]() 50mLNaOH��Һ�����ķ�Ӧ��
50mLNaOH��Һ�����ķ�Ӧ��![]() ��
�� ![]() ������50 mL
������50 mL![]() 60mLNaOH��Һ�����ķ�Ӧ��
60mLNaOH��Һ�����ķ�Ӧ��![]() ��Mg2����Al3����CO32-���ܹ���������һ������CO32-����2����ȡ����Һ20 mL��������BaCl2��Һ���õ�4.66 g����������ij������ó��������ᱵ�����ʵ�����0.02mol������ԭ��Һ����0.02mol SO
��Mg2����Al3����CO32-���ܹ���������һ������CO32-����2����ȡ����Һ20 mL��������BaCl2��Һ���õ�4.66 g����������ij������ó��������ᱵ�����ʵ�����0.02mol������ԭ��Һ����0.02mol SO![]() �����ݵ���غ��Ʋ�Cl���Ƿ��������3��K+ ����ͨ����ɫ��Ӧ������
�����ݵ���غ��Ʋ�Cl���Ƿ��������3��K+ ����ͨ����ɫ��Ӧ������
��������1������10 mL 1.0 mol��L��1 NaOH��Һû�г���������˵��ԭ��Һ����H������H�����ʵ�����0.01mol������NaOH��Һ��ֻ������ɫ������˵��û��Fe3������������������������������������٣��Ҳ�����ȫ�ܽ���˵��ԭ��Һ����Mg2����Al3��������10 mL![]() 50mLNaOH��Һ�����ķ�Ӧ��
50mLNaOH��Һ�����ķ�Ӧ��![]() ��
�� ![]() ������50 mL
������50 mL![]() 60mLNaOH��Һ�����ķ�Ӧ��
60mLNaOH��Һ�����ķ�Ӧ��![]() ���������Ϸ�����
���������Ϸ����� ![]() ������������0.01mol������Ԫ���غ��֪ԭ��Һ����0.01molAl3����
������������0.01mol������Ԫ���غ��֪ԭ��Һ����0.01molAl3���� ![]() ��
�� ![]() ��������������0.04mol�� 0.01molAl3��ͨ����Ӧ
��������������0.04mol�� 0.01molAl3��ͨ����Ӧ![]() ����0.03mol�������ƣ�����
����0.03mol�������ƣ�����![]() ������������0.01mol��ԭ��Һ����0.005mol Mg2����ˮ����һ�����е���������H+�� Al3+ ��Mg2+�������ʵ���֮����0.01:0.01:0.005=2��2��
������������0.01mol��ԭ��Һ����0.005mol Mg2����ˮ����һ�����е���������H+�� Al3+ ��Mg2+�������ʵ���֮����0.01:0.01:0.005=2��2��![]() ��H+�� Al3+ ��Mg2+�������������=0.01
��H+�� Al3+ ��Mg2+�������������=0.01![]() +0.01
+0.01![]() +0.005
+0.005![]() =0.05mol��SO
=0.05mol��SO![]() ���������������0.02mol
���������������0.02mol![]() =0.04mol�����ݵ���غ���һ������Cl������3���������Ϸ�������ȷ����������K+ ������ͨ����ɫ��Ӧ����K+�Ƿ������
=0.04mol�����ݵ���غ���һ������Cl������3���������Ϸ�������ȷ����������K+ ������ͨ����ɫ��Ӧ����K+�Ƿ������


