题目内容
【题目】滴定分析是一种常用的定量分析法。请回答下列问题:
Ⅰ.某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_________________________,直到因加入一滴盐酸后,溶液由黄色突变为橙色,并半分钟内不恢复为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_________(填字母序号)。
a.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
b.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
c.酸式滴定管在滴定前有气泡,滴定后气泡消失
d.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
Ⅱ.25℃时,向20mL 0.1 mol·L-1的HA溶液中逐滴加入0.1 mol·L-1NaOH溶液,滴加过程中混合溶液的pH变化曲线如图所示。
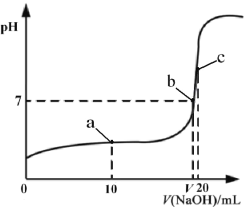
(3)①滴加NaOH溶液至恰好反应的过程中,水的电离程度_____________(填写“逐渐增大”、“不变”或“逐渐减小”);
②若以NaOH溶液为标准液,通过滴定的方法测定另一未知浓度的HA溶液的浓度,推测最好使用的指示剂为___________________________(常见指示剂的变色范围是:甲基橙3.1~4.4,酚酞8~10)。
③b点时,共滴入0.1 mol·L-1NaOH溶液体积为V mL,用含V的代数式表示HA的电离平衡常数Ka=__;
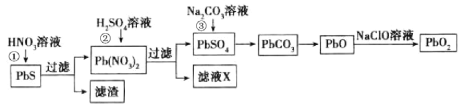
Ⅲ.KMnO4溶液常用作氧化还原反应滴定的标准液,四氯化硅粗产品经精馏后,得到的残留物中常含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++![]() +8H+=5Fe3++Mn2++4H2O
+8H+=5Fe3++Mn2++4H2O
(4)①滴定前是否要滴加指示剂?_____________ (填“是”或“否”),请说明理由:_____________________________________________;
②某同学称取10.000 g 残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用 1.000×10-2 mol·L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是______________________。
【答案】锥形瓶内溶液的颜色变化 d 增大 酚酞 ![]() 否 MnO4-转变成Mn2+溶液颜色由紫色变成无色 2.240%
否 MnO4-转变成Mn2+溶液颜色由紫色变成无色 2.240%
【解析】
Ⅰ.(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液的颜色变化,直到因加入一滴盐酸后,溶液由黄色突变为橙色,并半分钟内不恢复为止。
(2)a.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=![]() 可知,测定c(NaOH)偏大,故a错误;
可知,测定c(NaOH)偏大,故a错误;
b.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=![]() 可知,测定c(NaOH)无影响,故b错误;
可知,测定c(NaOH)无影响,故b错误;
c.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=可知,测定c(NaOH)偏大,故c错误;
d.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=![]() 可知,测定c(NaOH)偏低,故d正确;
可知,测定c(NaOH)偏低,故d正确;
故选d;
Ⅱ.(3)①酸抑制水的电离,氢离子浓度减小,则水的电离程度增大,滴加NaOH溶液至恰好反应的过程中,消耗氢离子,则氢离子浓度减小,所以水的电离程度逐渐增大;
②若以NaOH溶液为标准液,通过滴定的方法测定另一未知浓度的HA溶液的浓度,由图生成物NaA溶液呈碱性,推测最好使用的指示剂为酚酞;
③NaA为强碱弱酸盐,其溶液呈碱性,要使溶液呈中性,则酸应该稍微过量,呈中性时,溶液中c(Na+)=c(A-)=![]() mol·L-1,c(HA)=
mol·L-1,c(HA)=![]() ,电离平衡常数Ka=
,电离平衡常数Ka=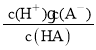 =
= =
=![]() ;
;
Ⅲ.(4)①MnO4-转变成Mn2+溶液颜色由紫色变成无色,KMnO4标准溶液在酸性条件下进行氧化还原滴定时,不需要指示剂;
②用关系式法计算:即5Fe2+~MnO4-,铁元素的质量为:5×1.000×10-2mol·L-1×0.02L×4×56g·mol-1=2.24×10-1g,铁元素的质量分数![]() ×100%=2.240%。
×100%=2.240%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】草酸![]() 溶液与酸性
溶液与酸性![]() 溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
(查阅资料)![]() 溶液氧化
溶液氧化![]() 的反应历程为:
的反应历程为:
![]()
(提出假设)假设1:该反应为放热
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是______。
(设计、完成实验)
![]() 称取______g草酸晶体
称取______g草酸晶体![]() ,配置500mL
,配置500mL![]()
![]() 溶液。
溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和______。
②下列操作会使所配溶液浓度偏低的是______![]() 填下列选项的字母序号
填下列选项的字母序号![]() 。
。
A 称取草酸晶体时,将草酸晶体放在托盘天平右盘
B 定容时俯视刻度线
C 将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D 摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
![]() 完成探究,记录数据
完成探究,记录数据
实验 编号 | 烧杯中所加试剂及用量 | 控制条件 | 溶液褪 色时间
| |||
| 等浓度
|
|
稀硫酸 | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | 水浴控制温度 | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量 |
|
4 | 30 | 20 | x | 20 | 加入5mL
| 18 |
则![]() ______,假设______成立。
______,假设______成立。
![]() 由于
由于![]() 能氧化水中有机物等因素,配置好稳定的
能氧化水中有机物等因素,配置好稳定的 溶液,其浓度需标定.取
溶液,其浓度需标定.取![]()
![]()
![]() 溶液于锥形瓶中,加入10mL
溶液于锥形瓶中,加入10mL![]() 稀硫酸,用
稀硫酸,用![]() 中
中![]() 溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗
溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗![]() 溶液
溶液![]() ,则草酸溶液与酸性
,则草酸溶液与酸性![]() 溶液反应的离子方程式为:______,上述实验中
溶液反应的离子方程式为:______,上述实验中![]() 溶液的物质的量浓度为______。
溶液的物质的量浓度为______。