题目内容
NA表示阿伏加德罗常数的值,下列说法正确的是
| A.7.8 g Na2O2中含有的离子总数目为0.4NA |
| B.1mol 苯分子中含有碳碳双键数目为3NA |
| C.标准状况下,将分子总数为NA的NH3和HCl气体混合后的体积约为22. 4L |
| D.16g CH4与18 g NH4+所含电子数均为10NA |
D
解析试题分析:A、7.8 g Na2O2中含有的钠离子为0.2mol,过氧根离子为0.1mol,离子总数目为0.3NA,错误;B、苯分子中不含碳碳双键,错误;C、NH3和HCl气体可以发生反应生成氯化铵,错误;D、正确。
考点:考查物质的量。

练习册系列答案
相关题目
有氧化铜和氧化铁的混合物a g,加入2 mol·L-1的硫酸溶液50 mL,恰好完全溶解,若将a g的该混合物在过量的CO气流中加热充分反应,冷却后剩余固体的质量为
| A.1.6 a g | B.(a-1.6)g | C.(a-3.2)g | D.无法计算 |
下列化学用语使用正确的是
A.Mg2+结构示意图: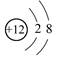 |
B.含18个中子的氯原子的核素符号: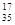 Cl Cl |
C.NH4Cl的电子式: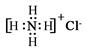 |
D.四氯化碳分子球棍模型: |
在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是
| A.两种气体的压强相等 | B.O2比O3质量小 |
| C.两种气体的分子数目相等 | D.两种气体的氧原子数目相等 |
下列各溶液中NO3-物质的量浓度最大的是
| A.20 mL 2 moL/L Mg(NO3)2 | B.100 mL 2.5 mot/L NaNO3 |
| C.25 mL 1.0mol/L Al(NO3)3 | D.30 mL 2.5 mol/L NH4NO3 |
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是
| A.定容时俯视液面 | B.所用NaOH已潮解 |
| C.未洗涤溶解NaOH固体的烧杯 | D.定容时仰视液面 |
设NA为阿佛加德罗常数,下列叙述中正确的是
| A.46 g NO2和 N2O4混合气体中含有原子数为3NA |
| B.标准状况下,22.4 LSO3与水反应生成1mol硫酸 |
| C.1L 1mol/L醋酸溶液中离子总数为2NA |
| D.足量铜与18mol·L-11L浓硫酸反应可以得到SO2的分子总数为9NA |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.0.2mol铁粉与足量水蒸气反应生成的H2分子数为0.3NA |
| B.常温常压下,0.1mol Na2O2与CO2完全反应转移电子数为0.1NA |
| C.50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
| D.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
下列关于物质的量浓度表述正确的是
| A.0.2 mol·L-1 Na2SO4溶液中含有Na+和SO42—总物质的量为0.6 mol |
| B.50mL 2 mol·L-1的NaCl溶液和100mL 0.5mol·L-1MgCl2溶液中,Cl-的物质的量浓度相等 |
| C.用1 L水吸收22.4 L氯化氢(标况下)所得盐酸的浓度是1 mol·L-1 |
| D.10 g 98%的硫酸(密度为1.84g · cm—3)与10mL 18.4mol·L—1的硫酸的浓度是相同的 |