题目内容
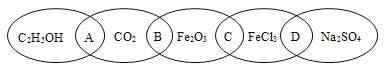
【题目】A、B、C、D、E、F、G、W是原子序数依次增大的8种元素,A元素原子的2p原子轨道上有 2个未成对的电子,B元素在同周期中原子半径最大,与A可形成原子个数比为1 : 1和2 : 1的两种化合物,C单质是一种常见的半导体材料,F有 9个原子轨道,G的单质是一种常见金属,W能形成红色(或砖红色)的W2A和黑色的WA两种氧化物。
(1)A元素在元素周期表中的位置是__________;写出B元素与A形成原子个数比为1 : 1的化合物的电子式____________________________ ;
(2)写出C基态时的价电子排布式:_______________________;
(3)D、E、F三者第一电离能从大到小的顺序是__________(用元素符号及“ > ”表示)。
(4)G位于元素周期表的位置是_________________, G3+比G2+稳定,原因是____________;
(5)W能形成红色(或砖红色)的W2A, W2A的化学式为_______________ ,W在周期表的_____ 区。
【答案】第二周期、第ⅥA族 ![]() 3s23p2 Cl> P> S 第四周期、第VIII族 Fe2+的价电子排布式为 3d6 ,Fe3+的价电子排布式为3d5, 3d5处于半充满的状态,结构更稳定,故Fe3+比Fe2+稳定 Cu2O ds
3s23p2 Cl> P> S 第四周期、第VIII族 Fe2+的价电子排布式为 3d6 ,Fe3+的价电子排布式为3d5, 3d5处于半充满的状态,结构更稳定,故Fe3+比Fe2+稳定 Cu2O ds
【解析】
(1)A元素原子的2p原子轨道上有 2个未成对的电子,则A为C或O,B元素在同周期中原子半径最大,则B为Na,又因A与Na形成两种化合物,则A为O,A元素在元素周期表中的位置是第二周期、第ⅥA族;原子个数比为1 : 1的化合物为过氧化钠,属于离子化合物,电子式为![]() ,
,
故答案为:第二周期、第ⅥA族;![]() ;
;
(2)C单质是一种常见的半导体材料,则C为Si,根据核外电子排布规律知C基态时的价电子排布式为:3s23p2;
故答案为:3s23p2;
(3)C、D、E、F原子序数依次增大,C为Si,F有 9个原子轨道,说明F也为第三周期的元素,则D为P,E为S,F为Cl,非金属性越强,第一电离能越小,又因为P的p轨道上为半满结构,P的第一电离能大于S,所以三者第一电离能从大到小的顺序是 Cl> P> S,
故答案为:Cl> P> S;
(4)G的单质是一种常见金属,G为Fe,Fe2+的价电子排布式为 3d6,Fe3+的价电子排布式为3d5,3d5处于半充满的状态,结构更稳定,故Fe3+比Fe2+稳定,
故答案为:Fe2+的价电子排布式为 3d6,Fe3+的价电子排布式为3d5,3d5处于半充满的状态,结构更稳定,故Fe3+比Fe2+稳定;
(5)W能形成红色(或砖红色)的W2A,则W2A的化学式为 Cu2O;根据铜原子外围电子排布的特征知W在周期表的ds区,
故答案为:ds。