题目内容
【题目】为测定Cl2、Br2的氧化性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)。实验步骤如图,填写图中的空白。
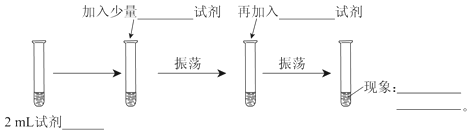
(1)2mL试剂___;
(2)加入少量___试剂;
(3)再加入___试剂;
(4)现象___。
(5)可以证明Cl2的氧化性___(填强于、弱于)Br2的氧化性。
(6)发生反应的离子反应方程式为___。
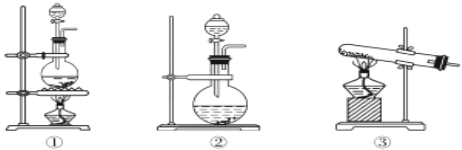
(7)实验室制取氯气用下面装置___(用①②③填写),试着写出制取氯气的反应方程式___。
【答案】NaBr溶液 氯水 CCl4 溶液分成两层,上层接近无色,下层橙红色 强于 Cl2+2Br-=Br2+2Cl- ① MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
【解析】
根据同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性来设计实验,要想比较氯气的氧化性大于溴的氧化性,只要使氯气和溴的盐溶液混合观察是否有溴单质生成,如果有溴单质生成就说明氯气的氧化性大于溴单质,否则不能证明;实验室用浓盐酸与二氧化锰在加热条件下发生反应制取氯气。
要想比较氯气和溴单质的氧化性大小,做如下实验:少量溴化钠溶液→加适量氯水(振荡,溶液由黄绿色变成橙色)→加入四氯化碳(振荡)→现象(溶液分层,下层橙红色,上层无色)→说明氯气和溴离子反应,能证明氯气的氧化性大于溴。则根据以上分析可知,
(1)2 mL试剂为NaBr溶液;
(2)加入少量氯水试剂;
(3)再加入CCl4(四氯化碳)试剂;
(4)根据以上分析可知,实验现象为滴入氯水后溶液呈橙色,加入四氯化碳后,溶液分成两层,上层接近无色,下层橙红色;
(5)氯气能将溴单质置换出来,因此该实验可以证明Cl2的氧化性强于Br2的氧化性;
(6)根据以上分析可知发生反应的离子反应方程式为Cl2+2Br-=Br2+2Cl-;
(7)实验室用浓盐酸与二氧化锰在加热条件下发生反应制取氯气,选择实验装置①,化学反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。

【题目】已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 900 | 1000 | 1200 |
平衡常数 | 0.5 | 0.6 | 1.0 | 1.6 | 2.0 |
回答下列问题:
(1)该反应的平衡常数表达式K= ______ ,△H= ______ 0(填“<”“>”“=”);
(2)900℃时,向一个固定容器为2L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始到2s内A浓度变化0.05molL-1.则A的平均反应速率v(A)= ______ .该反应达到平衡时A的转化率为 ______ ,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为 ______ (填”变大“、”变小“或”不变“)
(3)判断反应是否达到平衡的依据为 ______ (填字母代号).
a 压强不随时间改变 b 气体的密度不随时间改变
c c(A)不随时问改变 d 单位时间里生成C和D的物质的量相等
(4)1200℃时,若向另一相同容器中充入0.30molA、0.40mol B、0.40mol C和0.50molD,此时v正 ______ v逆(填”大于“、”小于“或”等于“).