题目内容
19.已知在K2HPO4溶液中HPO42-的水解程度大于电离程度,对于平衡HPO42-+H2O?H3O++PO43-,欲使溶液中c(HPO42-)、c(H3O+)、c(PO43-)三种离子浓度均减小,可采取的方法是( )| A. | 加水 | B. | 加少量消石灰固体 | ||
| C. | 加热 | D. | 加少量硝酸银固体 |
分析 在K2HPO4溶液中,存在着下列平衡:HPO42-?H++PO43-,HPO42-+H2O?H2PO4-+OH-,HPO42-的水解程度大于电离程度,则K2HPO4溶液呈碱性,
A.该溶液呈碱性,加水稀释,碱性减弱,酸性增强;
B.加消石灰后,氢氧根离子与氢离子反应生成水,钙离子与磷酸根离子反应生成磷酸钙沉淀,由于氢离子、磷酸根离子的减少,HPO42-也减少;
C.加热会促进电离平衡向右移动;
D.加入硝酸银会生成磷酸银沉淀.
解答 解:A.该溶液呈碱性,加水稀释,溶液中氢氧根离子浓度减小,则c(H3O+)增大,故A错误;
B.加入Ca(OH)2会使PO43-转化为Ca3(PO4)2沉淀,且c(H+)减小,使平衡右移.所以c(HPO42-)减小,故B正确;
C.加热会促进电离平衡向右移动,使c(PO43-)和c(H3O+)均增大,故C错误;
D.加入硝酸银会生成磷酸银沉淀,导致电离平衡正向移动,所以c(PO43-)减小,c(H3O+)增大,故D错误;
故选B.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确影响弱电解质的电离平衡及其影响因素为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
10.把镁带投入盛有盐酸的敞口容器里,在下列因素中:①盐酸的浓度,②镁带的表面积,③溶液的温度,④氯离子的浓度 ⑤滴加硫酸铜溶液.对反应速率有影响的是( )
| A. | ①② | B. | ③④ | C. | ①②③④ | D. | ①②③⑤ |
7.下列分离混合物的操作中,一定不须加热的是( )
| A. | 过滤 | B. | 升华 | C. | 结晶 | D. | 蒸馏 |
14.实验室中经常因为试剂的保存方法不当导致大量药品变质,下列试剂保存方法正确的是( )
| A. | 金属钠保存在水中 | |
| B. | 溴水放在带橡胶塞的试剂瓶中 | |
| C. | 硝酸银保存在棕色广口瓶中,并置于阴凉处 | |
| D. | 氢氧化钾溶液保存在磨口玻璃塞的试剂瓶中 |
4.某有机物的结构简式如图所示,下列有关说法中不正确的是( )
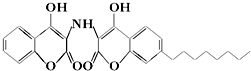

| A. | 分子式为C26H28O6N | |
| B. | 遇FeCl3溶液不能发生显色反应 | |
| C. | 1mol该物质最多能与8mol氢气发生加成反应 | |
| D. | 1mol该物质最多能与4molNaOH溶液完全反应 |
11.在标准状况下,mg气体A与ng气体B的分子数相同,下列说法中正确的是( )
| A. | 同温同压下,两气体A与B的密度之比为n:m | |
| B. | 同质量的A、B两种气体的分子数之比为m:n | |
| C. | 相同状况下,同体积的气体A和B的质量比为n:m | |
| D. | A与B两种气体的相对分子质量之比为m:n |
8.下列说法正确的是( )
| A. | 常温下,pH=3的盐酸、醋酸分别用水稀释m倍、n倍后pH相同,则m<n | |
| B. | △S>0的反应在一定条件下一定可以自发进行 | |
| C. | 以Al作阳极,Fe作阴极,可以实现铁上镀铝 | |
| D. | 工业合成SO3不采用高压是因为增大压强对SO2的转化率影响不大 |
9.0.1mol Na2SO4 溶液中钠离子的数目是( )
| A. | 6.02×1023 | B. | 2 | C. | 1.204×1023 | D. | 6.02×1022 |