题目内容
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A.在0.1 mol·L-1NaHCO3溶液中:c(Na+) >c(OH-)>c(HCO3-) >c(H+) |
| B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(Na+) -c(HCO3-) |
| C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(Na+)+c(H+) =c(OH-) +c(HCO3-) +c(CO32-) |
| D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L-1]: c(CH3COO-) =0.1 mol·L-1 |
D
试题分析:HCO3-的水解程度或电离程度均是很小的,A不正确,应该是c(Na+) >c(HCO3-) >c(OH-) >c(H+);根据电荷守恒可知,c(Na+)+c(H+) =c(OH-) +c(HCO3-) +2c(CO32-),因此选项BC 都是错误的;同样根据电荷守恒可知,D正确,答案选D。
点评:该题是中等难度的试题,也是高考中的常见题型与重要的考点。试题在注重对基础知识巩固与训练的同时,侧重对学生能力的培养。该题的关键是利用好几个守恒关系,即电荷守恒、物料守恒和质子守恒,并能结合同样灵活运用。

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目

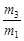


 氨水溶液加水稀释,下列说法正确的是
氨水溶液加水稀释,下列说法正确的是 
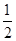 O2(g) = H2O(1)△H= ―285.8kJ/mol
O2(g) = H2O(1)△H= ―285.8kJ/mol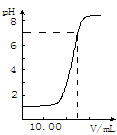
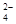 )∶c(H+)约为( )。
)∶c(H+)约为( )。